Données physico-chimiques
Données atomiques
| Formule |
Masse molaire |
Distance interatomique |
Structure cristalline |
| H2 |
2,0159 g.mol-1 |
74,2 pm |
hexagonale |
Données physiques
| Masse volumique |
Température de fusion |
Température de sublimation |
Température critique |
Pression critique |
Température point triple |
Pression point triple |
Limites d’explosivité dans l’air, en volume |
Solubilité dans l’eau |
| à l’état gazeux : 0,08988 g.L-1 |
-259,14°C |
-252,87°C |
-239,95°C |
1 300 kPa |
-259,35°C |
7,2 kPa |
4 – 76 % |
à 0°C : 2,14 cm3/100 g eau
à 80°C : 0,85 cm3/100 g eau
|
Données chimiques
| E° : 2H+aq + 2e = H2(g) |
E° : H2(g) + 2e = 2H– |
| 0 V par définition |
-2,25 V |
Données thermodynamiques
- Enthalpie molaire standard de fusion à la température de fusion : 0,1 kJ.mol-1
- Enthalpie molaire standard d’ébullition à la température d’ébullition : 0,9 kJ.mol-1
- Entropie molaire standard à 298,15 K : S° = 130,57 J.K-1mol-1
- Capacité thermique molaire sous pression constante à 298,15 K : Cp° = 28,8 J.K-1mol-1
Données industrielles
L’hydrogène bien qu’étant l’élément le plus présent dans l’univers (92 % atomique, 75 % en masse) est peu présent dans l’atmosphère terrestre avec une teneur volumique de 0,0005 %.
Chaque seconde, dans le soleil, 600 millions de t d’hydrogène sont converties, par fusion thermonucléaire, en hélium avec production d’énergie.
Sur terre, l’élément hydrogène est essentiellement présent sous forme combinée, principalement dans l’eau et les hydrocarbures. Sa teneur dans l’écorce terrestre est de 0,22 %, en masse.
Dans le corps humain, il représente 10 % de son poids.
Il existe des sources naturelles de dihydrogène. En 1906 une telle source avait été mise en évidence, en France, à Vaux en Bugey (01) lors d’un forage destiné à rechercher du sel, puis dans les années 1930 aux États-Unis. Du dihydrogène est présent dans des fluides hydrothermaux des dorsales médio-océaniques avec par exemple une teneur de 36 % de H2 en Islande, dans les gaz émis par les volcans, avec par exemple 58 % de H2 dans des gaz s’échappant de l’Etna, en Sicile, dans des eaux de sources hyperalcalines, par exemple en Oman, dans les mines…
Ces dernières années ont été découvertes, dans l’ouest de la Russie et aux État-Unis, des structures géologiques particulières, en surface, sous forme de dépressions circulaires ou ovoïdes de quelques centaines de mètres à quelques km de diamètre, émettant du dihydrogène à des débits qui peuvent atteindre 27 000 m3/jour. Toutefois, il n’est pas actuellement envisagé d’exploiter ces sources.
Au sud-ouest du Mali, la société canadienne Hydroma, ex Petroma, exploite un gisement de dihydrogène naturel, avec 1 200 m3/jour, permettant de produire, depuis 2011, de l’électricité pour le village de Bourakégougou.
Matières premières
Le dihydrogène est principalement obtenu à partir de l’eau, des hydrocarbures (gaz naturel et pétrole) ou du charbon.
Fabrication industrielle
Son principe repose sur la réduction de l’eau par :
- les hydrocarbures,
- le carbone,
- électrolyse.
Matières premières ou procédés utilisées, dans le monde, pour produire le dihydrogène, en 2014. Les matières premières sont à 96 % d’origine fossile.
En 2018, la consommation mondiale de gaz naturel pour produire du dihydrogène est de 205 milliards de m3 soit 6 % de la consommation totale. Pour le charbon, la consommation mondiale, principalement en Chine, est de 107 millions de t soit 2 % de la consommation totale. En Chine, en 2020, le charbon est à l’origine de 60 % de la production de dihydrogène, le gaz naturel, 25 % et le pétrole, 5 %.
Les émissions de CO2 résultant de ces consommations sont, en 2020, de 900 millions de t. Elles sont de 10 t de CO2/t de H2 pour une production à partir de gaz naturel et de 19 t CO2/t H2 à partir de charbon. Quelques projets de séquestration du CO2 produit ont été développés mais, en 2020, avec 16 installations, ils ne représentent que 700 000 t de H2 soit 0,7 % de la production mondiale.
Les parts relativement importantes des hydrocarbures liquides et du charbon sont dues à une coproduction de dihydrogène d’une part lors du raffinage du pétrole et d’autre part lors de la production de coke destiné à la sidérurgie. Par ailleurs, la production par électrolyse provient, à 90 %, d’une coproduction lors de l’obtention de dichlore et d’hydroxyde de sodium ainsi que lors de l’obtention du chlorate de sodium. L’électrolyse directe de l’eau ne concerne que 10 % de la production par électrolyse.
D’autre part, du dihydrogène est coproduit dans de nombreux autres procédés chimiques.
Reformage du gaz naturel
C’est la principale source de dihydrogène. Depuis 1970, le reformage du naphta est, en général, remplacé par celui du gaz naturel.
Principe : le gaz de synthèse (mélange de dihydrogène et de monoxyde de carbone) est produit par vaporeformage, à 800 – 900°C et à 3,3 MPa, en présence de catalyseur à base d’oxyde de nickel sur des anneaux d’alumine imprégnés par 10 à 16 % en masse de Ni (leur durée de vie est comprise entre 8 à 10 ans) :
CH4 + H2O = CO + 3 H2 ΔrH°298 = + 206,1 kJ/mole
La réaction, très endothermique, nécessite un apport continu d’énergie. Le mélange gazeux circule dans des tubes, chauffés extérieurement, contenant le catalyseur. De l’ordre d’une dizaine à quelques centaines de tubes (jusqu’à 500) de 10 cm de diamètre et 11 m de long sont placés dans un four. Après reformage, le mélange gazeux obtenu, appelé gaz de synthèse, contient de 5 à 11 % en volume de méthane non transformé.
Le catalyseur est très sensible à la présence de soufre qui donne du sulfure de nickel : moins de 1 atome de soufre pour 1000 atomes de nickel suffit pour empoisonner le catalyseur. Le gaz naturel doit être désulfuré à moins de 0,1 ppm de soufre. Après une prédésulfuration obtenue par hydrogénation catalytique suivie d’une absorption dans une solution aqueuse de diéthanolamine (voir la récupération du soufre des hydrocarbures dans le chapitre soufre), une nouvelle hydrogénation effectuée vers 350 – 400°C, permet, en présence de catalyseurs molybdène–cobalt ou molybdène-nickel, de transformer tous les composés soufrés en sulfure d’hydrogène. Le sulfure d’hydrogène est fixé, vers 380 – 400°C sur de l’oxyde de zinc selon la réaction :
H2S + ZnO = ZnS + H2O
En France, en 2019, il y a 17 unités de production de dihydrogène par reformage de gaz naturel avec une capacité de 1 317 t/jour.
Utilisation du gaz de synthèse pour produire de l’ammoniac (sans récupération de CO) :
On réalise un reformage secondaire en ajoutant de l’air en quantité telle que le diazote contenu soit, avec H2, dans les proportions stœchiométriques de la réaction de formation de NH3. Le dioxygène de l’air oxyde le méthane restant. Le catalyseur utilisé est à base d’oxyde de nickel.
Le monoxyde de carbone du gaz de synthèse est ensuite transformé, par conversion, en dioxyde de carbone avec production complémentaire de dihydrogène, en 2 étapes. On obtient ainsi un gaz contenant 70 % de H2.
CO + H2O = CO2 + H2 ΔrH°298 = – 41 kJ/mole
- à 320 – 370°C avec un catalyseur à base d’oxyde de fer (Fe3O4) et d’oxyde de chrome (Cr2O3) avec ajout métallique à base de cuivre. Le catalyseur est sous forme de pastilles obtenues à partir de poudre d’oxydes ou de spinelles, sa durée de vie de 4 à 10 ans et plus. Les 2 à 3 % en volume de monoxyde de carbone résiduel sont convertis dans une deuxième étape,
- à 205 – 240°C avec un catalyseur à base d’oxyde de cuivre (15 à 30 % en masse) et d’oxydes de chrome et zinc sur alumine, d’une durée de vie de 1 à 5 ans. Après conversion le monoxyde de carbone résiduel est d’environ 0,2 % en volume.
CO2 est éliminé par dissolution dans une solution d’amines à 35 bar ou dans une solution de carbonate de potassium. Par détente à la pression atmosphérique, CO2 est libéré, et la solution recyclée.
Le dihydrogène, en présence du diazote, est ensuite utilisé pour synthétiser l’ammoniac (voir ce chapitre).
Utilisation directe du gaz de synthèse pour produire du méthanol :
Le gaz de synthèse, obtenu par vaporeformage à partir du gaz naturel, vers 830°C, sous une pression de 18 bar, possède la composition suivante en volume : H2 (72 %), CO (13 %), CO2 (8 %), impuretés (eau, méthane). Il est alors refroidi et comprimé (15 à 100 bar), puis introduit dans le réacteur de synthèse. Les réactions ont lieu vers 250°C, en présence d’un catalyseur aux oxydes de cuivre et de zinc sur alumine (durée de vie de 3 ans) :
CO + 2 H2 = CH3OH ΔrH° = – 108 kJ/mol
CO2 + 3 H2 = CH3OH + H2O ΔrH° = – 68 kJ/mol
Les réactions étant exothermiques, il est nécessaire de refroidir le mélange réactionnel par une trempe (introduction de diazote froid dans le réacteur).
Le mélange final contient 75 % de méthanol et 25 % d’eau. Une distillation permet de séparer le méthanol des impuretés (eau, éthanol, diméthyléther, formiate de méthyle).
Utilisation du gaz de synthèse avec récupération de CO et H2 :
Le reformage est une source intéressante de dihydrogène et de monoxyde de carbone qui peuvent être séparés et commercialisés.
Après l’opération de reformage, la conversion n’est pas réalisée, le dioxyde de carbone présent est éliminé et le gaz de synthèse est séché. Le dihydrogène et le monoxyde de carbone sont alors séparés. Air Liquide utilise deux procédés cryogéniques :
- Par refroidissement dans des échangeurs et condensation du monoxyde de carbone : CO a une pureté de 97-98 % et H2 contient de 2 à 5 % de CO.
- Par refroidissement par lavage au méthane liquide : CO a une pureté de 98-99 %, et H2 ne contient que quelques ppm de CO.
Capacités des installations industrielles : couramment 100 000 m3/h et jusqu’à 220 000 m3/h.
Pyrolyse du charbon
Il contient environ 5 % de H2. La production de coke (par élimination des matières volatiles du charbon, à 1 100-1 400°C) donne un gaz contenant environ 60 % de H2 et 25 % de CH4 (1 t de charbon donne 300 m3 de gaz). Depuis l’utilisation du gaz naturel pour produire H2, le gaz de cokerie est souvent brûlé et l’énergie libérée récupérée (voir le chapitre gaz naturel). En 2008, la production française dans ce secteur a été de 127 000 t de dihydrogène, utilisées par combustion pour produire de l’énergie. En 2019, en France, il y a 3 cokeries possédant une capacité de production de 384 t de H2/jour.
Gazéification du charbon
Le charbon était le principal agent de réduction de l’eau et donc de production de dihydrogène avant l’utilisation, à grande échelle, du gaz naturel. Actuellement la gazéification du charbon est surtout utilisée en Chine et en Inde ainsi qu’en Afrique du Sud (par la société Sasol qui produit ainsi du gaz de synthèse destiné à fabriquer du carburant synthétique). En 2018, dans le monde, il y a 130 unités de production situées à 80 % en Chine.
Principe : il repose sur la formation du gaz à l’eau ou gaz de synthèse, à 1000°C.
C + H2O = CO + H2 ΔrH°298 = + 131 kJ/mole
La réaction, endothermique, nécessite un soufflage de dioxygène pour maintenir la température par combustion du carbone. La composition du gaz de synthèse obtenu est d’environ 50 % de H2 et 40 % de CO.
La production de H2 peut être améliorée par conversion de CO, voir ci-dessus.
La gazéification est réalisée dans des gazogènes (la principale technologie employée étant celle de Lurgi). Dans l’avenir, la gazéification souterraine pourrait être utilisée à grande échelle, voir le chapitre charbon.
Autres sources par coproduction
Raffinage du pétrole et pétrochimie :
- Reformage et craquage catalytique des produits pétroliers : 100 m3 de H2/t de pétrole brut sont produits lors du craquage catalytique. Le gaz obtenu ne possède qu’une teneur de 70 à 80 % en dihydrogène. Le raffinage pétrolier, principalement lors du craquage catalytique produit du dihydrogène mais, il en consomme également, principalement lors des désulfurations après hydrogénation (170 000 t, en France, en 2008).
- Oxydation partielle de coupes pétrolières (procédés Shell et Texaco). La production française a été, en 2008, de 5 000 t.
- Vapocraquage du naphta (production d’éthylène). La production d’éthylène donne 370 m3 de H2/t d’éthylène pour une consommation de 180 m3 de H2/t d’éthylène soit un bilan positif de 190 m3 de H2/t d’éthylène. En France, en 2019, il y a 6 unités de production avec une capacité de 129 t de H2/jour.
- Sous-produit de la fabrication du styrène : la production de dihydrogène est de 220 m3 de H2/t de styrène. En France, en 2019, il y a une unité de production avec une capacité de 36 t de H2/jour.
En France, en 2008, sur un total de 473 000 t de dihydrogène consommées par le raffinage pétrolier et la pétrochimie, 349 000 t ont été coproduites dans ces secteurs, 66 000 t produites volontairement sur le lieu d’utilisation pour un usage captif et 58 000 t de dihydrogène marchand achetées à des producteurs de gaz industriels.
Autres :
- Craquage du méthanol (procédé Grande Paroisse) : utilisé à Kourou en Guyane, par Air Liquide, pour produire le dihydrogène liquide (10 millions de L/an) destiné aux vols d’Ariane.
- La production d’acétylène par oxydation partielle du méthane (2 CH4 = C2H2 + 3 H2) qui donne 3 400 m3 de H2/t d’acétylène ou par décomposition d’hydrocarbure sous arc électrique qui donne 2 470 m3 de H2/t d’acétylène.
- Lors de la fabrication d’acide cyanhydrique selon la réaction : CH4 + NH3 = HCN + 3 H2 qui donne 2 470 m3 de H2/t de HCN.
- Gaz de purge des unités de fabrication d’ammoniac.
Électrolyse
De NaCl en solution aqueuse : H2 coproduit (28 kg de H2 par tonne de Cl2) donne 4 % du H2 mondial (12 % en Europe). Voir les chapitres dichlore et chlorate de sodium. La production française, en 2008, est de 51 000 t de H2. En 2019, en France, il y a 9 unités de production qui possèdent une capacité de production de 105 t de H2/jour.
De H2O : elle est principalement utilisée dans des applications industrielles qui sont localisées loin d’un réseau de distribution ou bien dans des applications où la consommation électrique de l’électrolyseur est marginale au regard de la consommation du procédé final. Le coût de production du dihydrogène, du moins pour les électrolyseurs de forte capacité (> 200 Nm3/h), est lié à celui de l’électricité. La consommation est comprise entre 4,5 kWh/m3 H2 pour les électrolyseurs de forte capacité à 6 kWh/m3 H2 pour des électrolyseurs de faible capacité (< 1 Nm3/h). Les capacités mondiales installées, 290 MW en 2020, soit, 30 000 t/an de H2, donnent 0,03 % du H2 mondial. Elles sont situées à 40 % en Europe, 9 % au Canada, 8 % en Chine. La production française, en 2008, est de 180 t. En 2019, en France, il y a 5 unités de production avec une capacité de 0,61 t/jour.
La technologie la plus utilisée avec, en 2020, 61 % des,capacités installées, est l’électrolyse alcaline avec comme électrolyte une solution aqueuse de KOH (de 25 à 40 % de concentration), en utilisant une eau la plus pure possible (filtration sur charbon actif et déminéralisation totale par résines échangeuses d’ions). La cathode est en acier doux activé par formation d’un dépôt de surface à base de Ni. L’anode est en acier nickelé ou en nickel massif. La tension est comprise entre 1,8 et 2,2 V. La puissance par électrolyseur peut atteindre 2,2 à 2,5 MW.
L’électrolyse à membrane échangeuse de proton (PEM : Proton Exchange Membrane), se développe fortement avec, en 2020, 31 % des capacités installées. Elle fonctionne à l’inverse des piles à combustible : alimentée en électricité et en eau elle fournit du dioxygène et du dihydrogène alors que les piles à combustibles sont alimentées en dioxygène et en dihydrogène et fournissent de l’électricité et de l’eau.
Les électrolyseurs de type PEM à électrolyte solide, ont été développés au cours du programme spatial américain Gémini-Apollo (1962-1966) afin de générer du dioxygène. Cette technologie est également employée comme générateur de dioxygène dans les sous-marins américains et britanniques. L’électrolyte, solide, est une membrane polymère conductrice de protons de type Nafion. Elle est actuellement en train de s’implanter dans les applications industrielles pour des capacité de production jusqu’à 50 Nm3/h. Plusieurs sociétés telles que Areva H2Gen, aux Ulis (91) développent des électrolyseurs PEM de l’ordre du MW pour répondre aux futurs marchés du stockage des énergies renouvelables. En octobre 2020, Areva H2Gen a été acquise par le groupe GTT et en février 2021 est devenue Elogen. En 2021, le plus important électrolyseur PEM a été inauguré, par Air Liquide, à Bécancour, au Canada d’une puissance de 20 MW avec une capacité de production de 3 000 t de H2 vert/an. Il utilise la technologie HyLYZER de Cummins, à l’aide d’hydroélectricité renouvelable.
D’autres technologies, issues des travaux sur les piles à combustible, sont en cours de développement :
- L’électrolyse à haute température (SOEC et PCFC).
- L’électrolyse à membrane échangeuse d’anions (AEM : Anion Exchange Membrane).
Les électrolyseurs à haute température de type SOEC (Solid Oxid Electrolyser Cells), fonctionnent entre 650 et 1000°C, avec un électrolyte solide en zircone, conductrice des anions O2-. La cathode, poreuse est alimentée en vapeur d’eau. Les anions O2- diffusent au travers de la zircone pour se recombiner en dioxygène sur l’anode. Le dihydrogène se forme à la cathode et reste en présence de la vapeur d’eau.
Les électrolyseurs à haute température de type PCFC (Proton Ceramic Fuel Cell), à électrolyte céramique conducteur protonique, fonctionnent entre 400 et 600°C. L’électrolyte peut être de diverses natures, par exemple de structure perovskite AMO3 avec A : Ba ou Sr, M : Ce ou Zr.
Obtention de H2 de haute pureté :
Des applications telles que l’électronique, l’agroalimentaire, la propulsion spatiale nécessitent du dihydrogène de très haute pureté. Souvent le dihydrogène de haute pureté est obtenu par électrolyse. Il est purifié par adsorption des impuretés sur du charbon actif (procédé PSA, voir le chapitre diazote). La pureté obtenue peut être supérieure à 99,9999 %.
Le dihydrogène et la transition énergétique
On distingue différents types de dihydrogène en fonction des émissions de dioxyde de carbone induites par sa fabrication et de leur influence sur le réchauffement climatique.
- Le dihydrogène noir est produit par gazéification du charbon sans séquestration du CO2 formé. C’est le plus préjudiciable au réchauffement climatique.
- Le dihydrogène gris, est produit à partir de sources fossiles, gaz naturel et pétrole, sans séquestration du CO2 associé. C’est actuellement la principale source de dihydrogène.
- Le dihydrogène bleu est toujours produit à partir de sources fossiles, mais une partie du CO2 émis est séquestré de telle sorte que son émission soit réduite de 60 % de celle qui serait émise sans séquestration.
- Le dihydrogène rose est produit par électrolyse à l’aide d’électricité provenant de réacteurs nucléaires.
- Le dihydrogène vert est issu de sources d’énergie renouvelables par exemple par électrolyse à condition que l’électricité utilisée soit issue de sources renouvelables.
Conditionnement – Transport
Auto-production : la plus grande partie du dihydrogène utilisé est auto-produite ou coproduite par les industries consommatrices : pour la production de NH3, de CH3OH, le raffinage pétrolier. En France, en 2008, 59 % de la consommation de dihydrogène provient d’une coproduction de dihydrogène lors de la production d’autres produits, 30 % d’installations captive et 11 % assurée par les producteurs de gaz industriels. En conséquence, le volume transporté est réduit. Dans le monde, en 2018, 85 % de la production est autoproduite par les industries consommatrices.
Transport par hydrogénoducs : les canalisations utilisées par Air Liquide ont un diamètre de 10 cm sous une pression de 100 bar.
Dans le monde, en 2016, le réseau a une longueur de 4 542 km.
Dans l’Union européenne, le réseau a, en 2016, une longueur totale de 1 609 km dont 1 349 km exploités par Air Liquide dans le Nord de la France, les Pays Bas et la Belgique (949 km), la Ruhr, en Allemagne (240 km), dans la région lyonnaise (57 km), celle de Fos-sur-Mer (42 km), voir les cartes dans le chapitre consacré au dioxygène. Le réseau exploité par Linde représente 172 km en Allemagne et au Royaume Uni, celui exploité par Air Products, 57 km principalement aux Pays Bas.
Le réseau développé aux États-Unis, par Air Products (1 062 km), Praxair (739 km), Air Liquide (545 km), possède une longueur de 2 608 km, principalement le long de la côte du Golfe du Mexique.
Compression : sous 200 ou 300 bar dans des tubes placés sur des semi-remorques (un millier, en Europe) contenant de 180 à 540 kg de dihydrogène, des wagons contenant 500 kg, des bouteilles de 10 m3 sous 200 bar. En 2006, en Europe, le volume transporté sous cette forme a été de 425 millions de m3.
Dihydrogène liquide : seule l’industrie spatiale utilise directement le dihydrogène liquide, les autres applications nécessitent sa retransformation à l’état gazeux.
Dans l’Union Européenne, en 2016, il y a 4 liquéfacteurs en fonctionnement avec une capacité de production totale de 26 t/jour, par Air Liquide à Waziers (59), avec 10,5 t/j, Air Products à Rozenburg (Pays Bas), avec 5,4 t/j, Linde, en Allemagne, à Ingolstadt, avec 4,4 t/j et Leuna, avec 5,7 t/j. Le dihydrogène liquide est transporté dans des camions citernes de 15 000 à 53 000 litres. La flotte d’Air Liquide est de 12 camions en Europe et 75 en Amérique du Nord.
Le liquéfacteur de L’Air Liquide à Waziers (59) est le plus important d’Europe (10,5 t/jour). Il est alimenté par du dihydrogène gazeux par canalisations. La capacité de stockage est de 750 000 L de dihydrogène liquide dans 3 réservoirs indépendants. Le dihydrogène produit est destiné, en priorité, aux essais du programme Ariane 5. Air Liquide exploite d’autres liquéfacteurs à Bécancour (Canada) avec 9,9 t/jour et à Kourou (Guyane) avec 2,5 t/jour.
La capacité de production des États-Unis est de 182 t/jour.
Productions
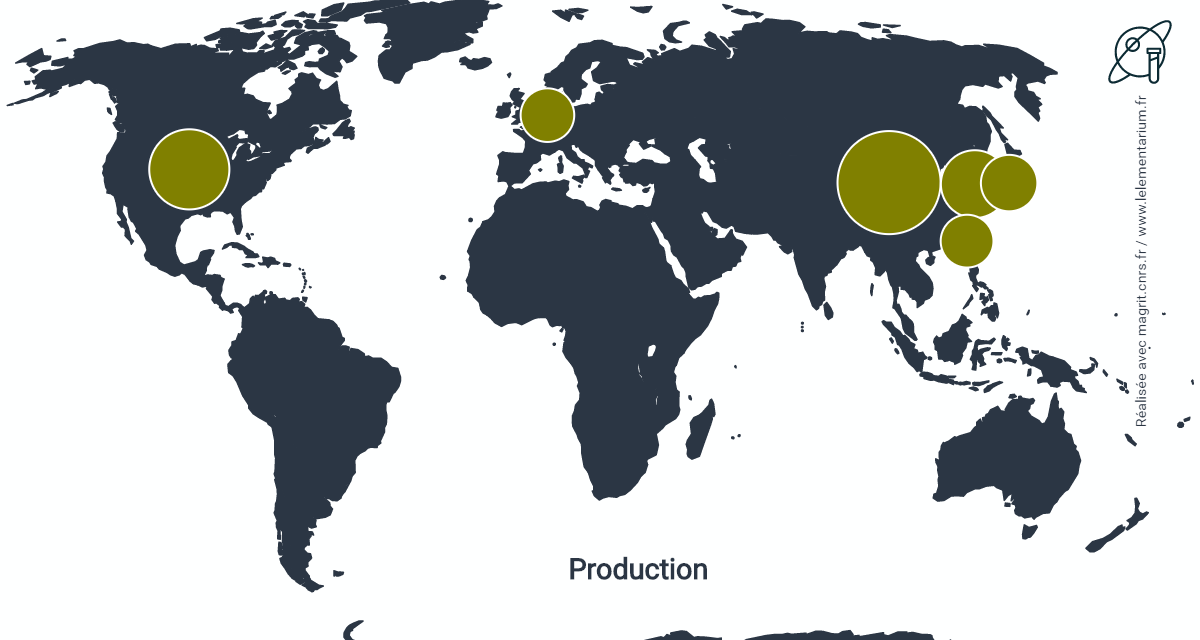
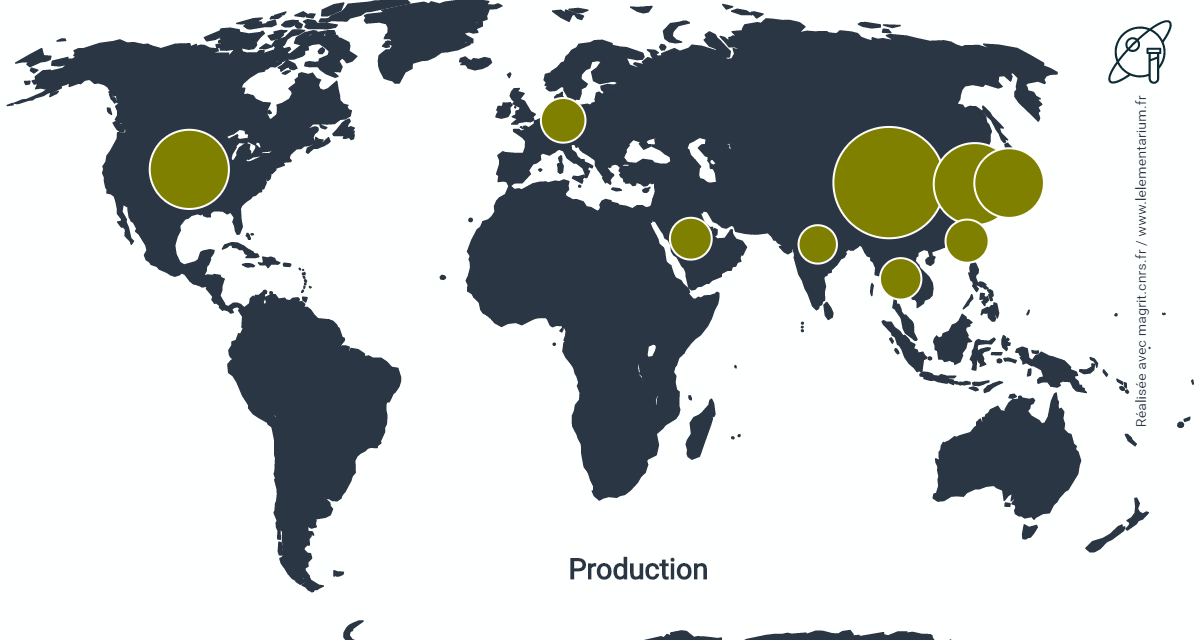
En 2020, pour le dihydrogène pur, hors celui présent dans le gaz de synthèse et non séparé du monoxyde de carbone. Monde : 72 millions de t, Chine, 22 millions de t, États-Unis, 10 millions de t. La production de dihydrogène mélangé au monoxyde de carbone dans le gaz de synthèse et destiné à la production de méthanol ou à la réduction directe des minerais de fer est de 18 millions de t.
Matières premières ou procédé utilisés pour la production de dihydrogène :
|
Monde |
|
Union européenne |
|
France |
| Gaz naturel |
49 % |
|
41 % |
|
40 % |
| Pétrole |
29 % |
|
42 % |
|
40 % |
| Charbon |
18 % |
|
5 % |
|
14 % |
| Électrolyses |
4 % |
|
12 % |
|
6 % |
Sources : IHS, IFP, Actualité chimique n°347, CETH2
La part importante du pétrole provient principalement d’une coproduction lors de son raffinage. De même, en France, pour le charbon, le dihydrogène provenant d’une coproduction lors de la fabrication du coke destiné à la sidérurgie.
Fin 2020, dans l’Union européenne à 28 plus la Norvège, la Suisse, le Royaume Uni et l’Islande, il y a 504 sites de production de dihydrogène avec une capacité de production de 11,5 millions de t/an et de 12,2 millions de t/an si on tient compte de celui co-produit lors de l’élaboration du coke. Ces capacités se répartissent selon les proportions suivantes :
- 80,4 % sont captives et utilisent le reformage avec 161 unités de production destinées à 55 % pour le raffinage du pétrole, 37 % à produire de l’ammoniac, 8 % pour d’autres applications chimiques dont la production de méthanol.
- 10,4 % sont des productions marchandes utilisant le reformage avec 91 unités. En 2024, dans l’Union européenne, la production est de 1,186 million de t dont 289 054 t en Allemagne, 184 614 t aux Pays Bas, 166 907 t en Belgique, 130 689 t en Pologne, 113 249 t en France, 65 073 t en République tchèque, 60 579 t en Espagne, 53 838 t en Italie, 38 379 t en Hongrie, 28 761 t en Finlande, 28 402 t au Portugal.
- 4,8 % sont issues de coproductions avec 135 unités de production et une capacité de 0,43 million de t/an provenant de la production d’éthylène et 0,13 million de t/an de celle du styrène.
- 3,7 % sont des coproductions provenant d’électrolyses avec 0,36 million de t/an provenant de la production du dichlore et de la soude et 0 06 million de t/an de celle des chlorates.
- 0,5 % sont des installations captives, au nombre de 3, utilisant un combustible fossile, avec capture du dioxyde de carbone émis.
- 0,1 % utilisent l’électrolyse de l’eau avec 143 unités de production.
Capacités de production, fin 2020, dans l’Union européenne, sur un total de 10,62 millions de t/an.
en millions de t/an
| Allemagne |
2,09 |
|
France |
0,82 |
| Pays Bas |
1,55 |
|
Espagne |
0,79 |
| Pologne |
1,03 |
|
Belgique |
0,57 |
| Italie |
0,85 |
|
Grèce |
0,39 |
Producteurs :
- Utilisations captives : producteurs d’engrais (NH3), d’éthylène, raffineries de pétrole. Par exemple, dans le monde, début 2016, les capacités de production des raffineries de pétrole sont de 13,3 millions de t dont 3,7 millions de t/an, aux États-Unis. Le principal producteur mondial de dihydrogène est le groupe chinois CHN Energy qui à l’aide de 80 unités de gazéification du charbon produit 8 millions de t/an de H2.
- Producteurs d’hydrogène marchand : dans le monde, fin 2016, la capacité de production est de 23 650 t/jour, en Europe, plus Norvège, Suisse et Islande, en 2018, elle est de 4 246 t/jour à 39 % par Linde, 36 % par Air Liquide, 13 % par Air Products, aux États-Unis, de 13 643 t/jour à 42 % par Air Products, 35 % par Praxair, 13 % par Air Liquide, 8 % par Linde.
- Air Products possède une capacité de production de 8 553 t/jour avec 60 unités de production,
- Linde, 8 522 t/jour après la fusion, en février 2019, avec Praxair,
- Air Liquide, 5 130 t/jour. En 2019, la capacité de production d’Air Liquide est de 1,26 million de t/an, à partir de 46 grandes unités de production de gaz de synthèse et de 40 électrolyseurs. Le réseau de pipeline est de 1 850 km, en Europe, aux États-Unis (voir ci-dessus) et à Singapour.
Commerce international : en 2024.
Principaux pays exportateurs :
en tonnes
| Canada |
33 519 |
|
Belgique |
1 687 |
| Singapour |
9 780 |
|
Allemagne |
1 599 |
| Pays Bas |
4 178 |
|
Suède |
1 473 |
| France |
2 149 |
|
Slovaquie |
906 |
Source : ITC
Les exportations canadiennes sont destinées totalement aux États-Unis.
Principaux pays importateurs :
en tonnes
| Indonésie |
5 472 |
|
Belgique |
799 |
| Canada |
4 119 |
|
Portugal |
622 |
| France |
2 252 |
|
Danemark |
571 |
| Autriche |
815 |
|
Allemagne |
568 |
Source : ITC
Les importations des États-Unis n’ont pas été prises en compte. Les importations indonésiennes proviennent quasi totalement de Singapour.
Situation française
Les valeurs des productions sont, si non précisées, celles de 2008.
Production
922 000 t.
Productions captives : avec une capacité de production, en 2019, de 1 050 t/jour à partir 7 unités de reformage de gaz naturel.
- Pour la production d’ammoniac : 215 000 t, par Borealis, à Grandpuits (77), Grand Quevilly (76) et Ottmarsheim (68) et Yara, au Havre (76).
- Pour le raffinage pétrolier par reformage de gaz naturel : 292 000 t, TotalEnergies, à Gonfreville (76), Donges (44), Feysin (69) et Grandpuits (77), Esso à Port Jérôme (76) et Fos-sur-Mer, Ineos à Lavera (13).
Coproductions : avec une capacité de production, en 2019, de 611 t/jour, à partir de 17 unités de production.
- D’éthylène, styrène : 139 000 t, TotalEnergies à Gonfreville (76), Feysin (69) et Lavera (13), ExxonMobil à Notre Dame de Gravenchon (76), Versalis, filiale du groupe Eni, à Dunkerque (59), Lyondellbasell à Berre l’Étang (13).
- Cokeries : 127 000 t, ArcelorMittal, à Fos-sur-Mer (13), Dunkerque (59) et Sérémange (57).
- D’électrolyses : 51 000 t, Vencorex à Pont de Claix (38), Tessenderlo à Loos (59), Vynova PPC à Than (68), Nouryon à Ambès (33), Inovyn à Tavaux (39), Arkema à Jarrie (38) et Saint-Auban (04), Kem One à Lavera (13) et Fos-sur-Mer (13).
Productions marchandes : avec une capacité de production, en 2019, de 326 t/jour. En 2024, la production a été de 113 249 t.
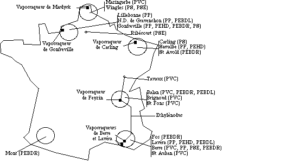
- Air Liquide à Port Jérôme (76), avec une capacité de production de 54 t/j, Gueugnon (71), avec 1,7 t/j, Waziers (59), avec 10,5 t/j, Lacq (64), avec 3,9 t/j, Le Pont de Claix (38), avec 22,2 t/j, Saint Fons (69), avec 32,4 t/j et Lavera (13), avec 54 t/j, principalement par reformage de gaz naturel (voir cartes dans le chapitre dioxygène).
- Linde à Fos sur Mer (13), avec 1,9 t/j et Chalampé (68), avec 45 t/j, par reformage d’hydrocarbures.
- Messer, à Saint-Leu-d’Esserent (60).
Commerce extérieur
En 2024.
Les exportations étaient de 2 149 t avec comme principaux marché à :
- 79 % l’Allemagne,
- 13 % l’Espagne,
- 4 % la Suisse.
Les importations s’élevaient à 2 252 t en provenance principalement à :
- 34 % de Belgique,
- 30 % des Pays Bas,
- 20 % d’Allemagne,
- 12 % d’Espagne.
Utilisations
Consommations : dans le monde, elles sont estimées, en 2020, à 70 millions de t/an dont 1 million de t/an en France sous forme de dihydrogène pur ainsi que de 50 millions de t/an sous forme de dihydrogène mélangé à d’autres gaz (gaz de synthèse…) destiné à la fabrication de méthanol, à la réduction directe de minerais de fer ou comme source de chaleur.
Consommations lors de diverses productions :
- Synthèse de NH3 : 1 975 m3/t NH3.
- Synthèse du méthanol : 1 500 m3/t CH3OH.
- Fabrication du peroxyde d’hydrogène : 735 m3/t de H2O2.
- Hydrocraquage : 300 m3/t de produit.
Secteurs d’utilisation : en 2018.
|
Monde |
|
Europe* |
|
France |
| Raffinage du pétrole |
33 % |
|
45 % |
|
60 % |
| Ammoniac, engrais |
27 % |
|
34 % |
|
25 % |
| Chimie de base, dont méthanol |
11 % |
|
12 % |
|
10 % |
| Métallurgie |
3 % |
|
– |
|
1 % |
Sources : Actualité chimique n°347, Alphea, France Stratégie, IFP, IEA
*: l’Europe prend en compte l’UE à 28 plus la Norvège, la Suisse et l’Islande.
Dans le tableau ci-dessus, le dihydrogène utilisé par la sidérurgie pour sa valeur énergétique (gaz de cokerie, gaz de haut fourneaux) n’est pas pris en compte. Pour la France sa prise en compte donne les valeurs suivantes : raffinage : 51 %, ammoniac : 26 %, sidérurgie : 14 %, chimie : 8 %, métallurgie : 1 %.
La principale application est la pétrochimie puisque cette application, anciennement excédentaire en hydrogène est maintenant déficitaire en hydrogène à cause des réglementations environnementales qui nécessitent de pousser plus loin la désulfuration des produits raffinés.
Utilisations diverses :
- Hydrodésulfuration et hydrocraquage des coupes pétrolières. L’hydrodésulfuration est destinée à l’élimination du soufre : réalisée sous 40 bar, entre 330 et 400°C avec comme catalyseurs des sulfures de Mo et Co. Les sociétés pétrolières qui, en général, produisent elles-mêmes le dihydrogène qu’elles consomment, font appel de plus en plus à un approvisionnement par les producteurs de gaz industriels. Par exemple, aux États-Unis, Air Products et Praxair alimentent, dans la région de Houston, des raffineries de pétrole par pipeline.
L’hydrocraquage consiste à casser les chaînes carbonées des hydrocarbures lourds de la charge pour obtenir des produits plus légers.
- Synthèse de l’ammoniac utilisé surtout dans l’industrie des engrais : voir les chapitres consacrés à l’ammoniac et aux engrais. En 1989, les pays producteurs d’hydrocarbures (pétrole, gaz naturel), donc de matières premières pour la fabrication du dihydrogène, assuraient 72 % de la production mondiale d’urée, 48 % de celle du méthanol, 47 % de celle de l’ammoniac. La consommation mondiale de dihydrogène dans ce secteur est, en 2020, de 22 millions de t. Des projets sont en cours de développement pour produire de l’ammoniac « vert ». Par exemple, en Australie Western Green Energy Hub à l’aide de 50 GW d’électricité photovoltaïque et éolienne compte produire 3,5 millions de t/an de dihydrogène destiné à produire 20 millions de t/an d’ammoniac. En Espagne, la société Iberdrola développe pour 2021 un projet de production de dihydrogène par électrolyse à l’aide de 100 MW d’électricité photovoltaïque destiné à l’usine Fertiberia de Puertollano de production d’ammoniac permettant ainsi d’éviter l’émission de 39 000 t de CO2/an.
- Méthanol : voir ce chapitre. En 2020, la consommation de dihydrogène dans ce secteur est de 14 millions de t.
- Industrie du verre : protection contre l’oxydation du bain d’étain fondu utilisé pour produire le verre plat : verre flotté (float).
- Gaz pour respiration sous-marine : 49 % H2 – 50,2 % He – 0,8 % O2 utilisé par la Comex, en 1988, pour établir le record de plongée sous-marine à 520 m. En novembre 1992, le record a été porté à 701 m à l’aide d’un mélange gazeux aux proportions légèrement modifiées.
- Sidérurgie : lors de la réduction directe des minerais de fer (5 millions de t/an) ainsi que pour le recuit des bobines de tôles minces.
- Hydrogénation des huiles insaturées pour produire la margarine.
- Fabrication du peroxyde d’hydrogène, voir ce chapitre.
- Atmosphères non oxydantes pour fritter des poudres métalliques (W…), les pastilles de combustible nucléaire.
- Refroidissement des paliers d’alternateurs (d’une puissance supérieure à 150 MW) dans toutes les centrales électriques du monde. C’est actuellement un des plus gros marchés de vente d’électrolyseurs dans le monde.
- Source d’énergie non polluante (production d’eau en présence de O2 de l’air) et de haute densité énergétique : 121 kJ/g (50,3 kJ/g pour le méthane) utilisée en propulsion spatiale par Safran et Arianespace. Ariane 5 emporte 162 t de dioxygène liquide et 28 t de dihydrogène liquide pour l’alimentation de son moteur cryogénique.
Le dihydrogène commence à être utilisé comme « vecteur énergétique » dans les piles à combustible, destinées, en particulier, aux véhicules de transport, par exemple pour les Toyota Miraï, Hyandaï Nexo ou Honda Clarity, avec 43 000 véhicules en circulation dans le monde mi-2021, avec 74 % de véhicules particuliers et 16 % de bus.
Dans le monde, des stations de fourniture de dihydrogène commencent à s’implanter avec, en 2018, 381 stations dans le monde dont 130 au Japon, 89 en Allemagne, en 2019, 63 aux États-Unis, 58 en France, en 2023. Par exemple, Air Liquide a conçu et fournit dans le monde 120 stations. En France, la première a été construite à Saint-Lô (50) en 2015. En 2018, en Ile de France, fonctionnent 4 stations, à Paris, au pont de l’Alma, sur la zone aéroportuaire d’Orly, à Versailles pour alimenter des bus et à Roissy Charles de Gaulle. A Paris, la société de taxis Hype utilise plus de 100 véhicules fonctionnant à l’hydrogène.
En France, une première ligne avec 2 bus fonctionnant avec une pile à combustible a été inaugurée en septembre 2019 entre Versailles et Jouy-en-Josas. d’autres sont prévues dans le Pas de Calais, à Pau et à Auxerre. En 2023, 33 bus sont en activité.
En Allemagne, le land de Basse Saxe, a commandé à Alstom 14 trains fonctionnant à l’aide d’une pile à combustible pour une mise en service fin 2021. Deux premiers trains sont entrés en service commercial en septembre 2018.
Conversion de l’électricité en gaz (Power to Gas) :
La production d’énergie par des sources renouvelables comme l’éolien et le solaire est intermittente. Le stockage de l’énergie superflue est actuellement, réalisé à 99 % par pompage de l’eau de barrage, avec, en 2012 dans le monde, une puissance installée de 128 GW. Des études sont en cours afin d’utiliser l’électricité excédentaire pour produire du dihydrogène par électrolyse.
L’hydrogène ainsi produit peut être utilisé, via une pile à combustibles, pour produire de l’électricité pendant les périodes de non production des sources intermittentes. Par exemple, une plateforme expérimentale Myrte (Mission hydrogène renouvelable pour l’intégration au réseau électrique) fonctionne en Corse, à Ajaccio, sur le site de l’Université de Corse à Vignola. Elle est constituée d’une centrale photovoltaïque de 560 kWc et d’une chaîne hydrogène comprenant un électrolyseur de 10 m3/h, des cuves de stockage du dihydrogène de 1 400 m3 et du dioxygène de 700 m3 et une pile à combustible de 100 kW.
Le dihydrogène produit par électrolyse peut aussi être injecté dans le réseau de distribution de gaz naturel. Par exemple, le projet Grhyd, à Cappelle-la-Grande, dans la banlieue de Dunkerque (59), piloté par Engie et inauguré en juin 2018 et qui a fonctionné jusqu’en mars 2020, a consisté à alimenter un nouveau quartier de 200 logements par un mélange de dihydrogène et de gaz naturel. L’enjeu principal de ce projet était d’évaluer la proportion optimale (a priori jusqu’à 20 %) de dihydrogène à injecter dans les canalisations afin de tester leur résistance. Le projet consiste également a alimenter une flotte de 30 bus roulant à Hythane, gaz naturel enrichi à 7 % puis 20 % de dihydrogène.
Enfin, après électrolyse, le dihydrogène peut réagir avec du dioxyde de carbone (réaction de méthanation) pour produire du méthane synthétique pouvant être injecté dans le réseau de gaz naturel. La réaction de méthanation ou réaction de Sabatier est la suivante :
CO2 + 4 H2 = CH4 + 2 H2O ΔrH°298 = -165 kJ/mole
Elle est réalisée entre 320 et 430°C et entre 5 et 15 bar et nécessite l’utilisation de catalyseurs tels que, par exemple, du nickel sur alumine. La difficulté de la maîtrise de cette réaction réside dans sa forte exothermicité. Divers démonstrateurs sont en fonctionnement ou en projet. Par exemple, le projet Jupiter 1000, à Fos-sur-Mer (13), est piloté par GRT Gaz, filiale d’Engie. Le dihydrogène proviendra de deux électrolyseurs de 0,5 MW chaque, l’un par électrolyse alcaline, l’autre par membrane échangeuse de proton (PEM), l’électricité étant produite à l’aide de sources renouvelables. La production prévue est de 200 m3/h de dihydrogène. Dans un premier temps, en juin-juillet 2018, le dihydrogène sera injecté dans le réseau de gaz naturel. Ensuite, une partie du dihydrogène sera transformé en méthane synthétique par méthanation à l’aide de dioxyde de carbone capté dans les fumées d’une usine voisine, avec une production prévue, en 2019, de 25 m3/h, qui sera injectée dans le réseau de gaz naturel.
Bibliographie
- Air Liquide, 75 Quai d’Orsay, 75321 Paris Cedex 07.
- Energy Hydrogen Alliance, 3/4/5 Avenue des Arts, 1210 Bruxelles, Belgique.
- Clean Hydrogen Monitor, Hydrogen Europe.
- Fuel Cells and Hydrogen Observatory, Av. de la Toison d’or 56-60, BE-1060 Bruxelles, Belgique.
- Hydrogen Council, Av. Marnix 23, Bruxelles 1000, Belgique.
- France Hydrogène, 50 Av. Daumesnil 75012 Paris.
- Hydrogen Analysis Resource Center, US Department of Energy.
- « Plan de déploiement de l’hydrogène pour la transition énergétique« , CEA et Ministère de la Transition Ecologique et Solidaire, 2018.
- Chauvel, Procédés de pétrochimie, tome 1, Technip, 1985.
- F. Giroudière, A. Le Gall, Production des gaz de synthèse par vaporeformage, Techniques de l’Ingénieur, 2012.
- F. Lefebvre-Joud, L. Briottet, O. Gillia, F. Nony, Matériaux de la filière hydrogène, Stockage et transport, Techniques de l’Ingénieur, 2010.
- C. Boyer, L’hydrogène, Techniques de l’Ingénieur, 2012.
- A. Le Duigou, M. Miguet, Les marchés de l’hydrogène industriel français, L’Actualité chimique, n°347, Décembre 2010.
- Hydrogène, Lego® de la transition énergétique, Les Défis du CEA, n°227, mai 2018.
- J. Ducamp et al, « Statu quo sur la méthanisation du dioxyde de carbone : une revue de littérature« , Comptes Rendus de Chimie, mars-avril 2018, p 417-469.
- Fiche technique, L’hydrogène dans la transition énergétique, Ademe, mars 2018.
- « The future of hydrogen« , IEA, juin 2019.
- « Global hydrogen review » 2022, IEA.
- « Cap sur l’hydrogène« , Air Liquide, 2018.
- « Rôle de l’hydrogène dans une économie décarbonée » Académie des Technologies, juin 2020.
Archives
Dihydrogène 2023
Dihydrogène 2022
Dihydrogène 2019
Dihydrogène 2015
Dihydrogène 2014
Dihydrogène 2010
Dihydrogène 1991



Commentaires récents