Le dichlore est principalement préparé par électrolyse de solutions saturées de chlorure de sodium. À cette production est associée celle d’hydroxyde de sodium. Les cellules d’électrolyse à cathode de mercure, particulièrement utilisées en Europe, viennent de disparaître sur ce continent en étant, en général, remplacées par des cellules à membranes.
Données physico-chimiques
Données atomiques
| Formule | Masse molaire | Distance interatomique |
| Cl2 | 70,906 g.mol-1 | 198,8 pm |
Données physiques
| Masse volumique | Température de fusion | Température d’ébullition | Température critique | Pression critique | Conductibilité thermique | Solubilité dans l’eau |
|
-100,98°C | -34,6°C | 144°C | 7 700 kPa | 0,0079 W.m-1K-1 |
|
Données chimiques
| E° : ClO3– + 6H+ + 5e = 1/2Cl2(g) + 3H2O | E° : Cl2(g) + 2e = 2Cl– | E° : 2HClO + 2H+ + 2e = Cl2(g) + 2H2O | E° : 2ClO– + 2H2O + 2e = Cl2(g) + 4OH– |
| 1,47 V | 1,358 V | 1,63 V | 0,40 V |
Données thermodynamiques
Dichlore gazeux :
|
Dichlore en solution aqueuse :
|
Données industrielles
Le dichlore est un produit synthétique préparé par l’industrie chimique principalement par oxydation électrochimique d’ions chlorure.
L’élément chlore est présent dans l’eau de mer sous forme d’ion chlorure avec, en moyenne, 19 g.L-1 soit 26.1015 t de Cl– et dans la croûte terrestre (avec une teneur moyenne de 0,03 %) sous forme de sels (NaCl, KCl…).
Il est également présent dans l’atmosphère sous forme de chlorure d’hydrogène (production mondiale de 0,5 à 11 millions de t/an par les éruptions volcaniques) et de chlorure de méthyle (5 millions de t/an provenant d’algues marines…).
Le corps humain contient 0,15 % de sa masse en ions chlorure (le sang à une teneur de 4,5 à 6 g.L-1, la concentration des sucs gastriques est de 0,03 mol.L-1 d’acide chlorhydrique).
Matières premières
Principalement le chlorure de sodium, NaCl, solide (naturel ou recristallisé) ou en solution aqueuse afin d’obtenir des saumures contenant environ 320 g.L-1 de NaCl. La consommation de NaCl est de 1,7 t/t de Cl2. Le chlorure de potassium est également utilisé, en moindre quantité, lorsque l’on désire obtenir comme coproduit de l’hydroxyde de potassium.
Fabrication industrielle
Principalement par électrolyse.
A partir généralement de NaCl en solution, mais aussi à partir de KCl en solution et NaCl fondu, en France, à Pomblière Saint Marcel (73), coproduit de la fabrication du sodium, voir le chapitre consacré au sodium.
Du dichlore est produit, selon le procédé Deacon, à partir de HCl gazeux, lors de la fabrication de chlorure de vinyle (voir le chapitre PVC) mais il est immédiatement consommé. Par ailleurs, Covestro, en Chine à Shanghai produit, selon le procédé Deacon, du dichlore, avec une capacité de production de 320 000 t/an, à partir du chlorure d’hydrogène coproduit lors de la fabrication d’isocyanates et ainsi le recycle.
Du dichlore est également produit en Europe de l’ouest (environ 3 % de la production), à partir de HCl, sous-produit de chlorations organiques, par électrolyse de solutions aqueuses (capacité mondiale : 2 millions de t/an de Cl2). En Europe, cette production, a exclusivement lieu en Allemagne par la société Covestro. Le procédé Uhde, utilisé depuis les années 70, emploie de l’acide à des concentrations comprises entre 15 et 22 % dans des cellules à diaphragme. Le procédé De Nora, basé sur la technologie ODC (Oxygen Depolarised Cathode), utilise une séparation par membrane. Cette technologie qui apporte du dioxygène à la cathode permet, en formant de l’eau, d’éviter de produire du dihydrogène et ainsi diminue la surtension nécessaire (économie de 30 % d’électricité).
L’électrolyse a lieu dans des cellules de 3 types : en % des capacités de production.
| Capacités de production | Monde, en 2019 | Union européenne, en 2024 | France, en 2024 |
| Membrane | 80 % | 86,8 % | 84,0 % |
| Diaphragme | 15 % | 8,4 % | 12,9 % |
| Mercure | 4 % | 0 % | 0 % |
| Divers | 1 % | 4,7 % | 3,0 % |
Sources : Euro Chlor et IHS
La plus importante usine de production, dans le monde, est celle exploitée par Olin, à Freeport, au Texas, aux États-Unis. Sa capacité de production est de 3,030 millions de t/an, 1,580 million de t/an par électrolyse à diaphragme et 1,450 million de t/an par électrolyse à membrane.
La plus importante unité de production en Europe est installée chez Dow Chemical à Stade, en Allemagne, avec une capacité de 1,024 million de t/an de Cl2 par électrolyse à diaphragme associée à une capacité de 600 000 t/an de Cl2 par électrolyse à membrane.
Il n’y a plus de projet, dans le monde, de construction d’usine à cathode de mercure. En 2018, l’abandon total de leur exploitation a eu lieu, en Europe.
En général, les nouvelles unités de production fonctionnent à l’aide de cellules à membranes.
Caractéristiques des différents procédés
| Procédé | Densité de courant (kA/m2) | Tension (V) | Consommation totale d’énergie (kWh/t Cl2) | ||
| Électrolyse | Concentration | Force motrice | |||
| Membrane | 5 – 7 | 3 – 3,6 | 2 500 à 5 kA/m2 | 180 | 140 |
| Diaphragme | 0,9 – 2,6 | 2,9 – 3,5 | 2 720 à 1,7 kA/m2 | 610 | 250 |
| Mercure | 8 – 13 | 3,9 – 4,2 | 3 360 à 10 kA/m2 | 0 | 200 |
Consommation d’énergie électrique : de 2 310 à 3 460 kWh/t de dichlore en 2022, en Europe, pour des cellules à membranes. En 2022, en Europe, la consommation d’énergie électrique représente de 58 à 62 % des coûts de production de Cl2.
Cellules à membrane
Schéma de fonctionnement (sur le site Euro Chlor)
Elles utilisent généralement du sel cristallisé mis en solution. La saumure doit être fortement purifiée (à l’aide de résines échangeuses d’ions). La concentration en Mg2+ et Ca2+ doit être inférieure à 20 ppb. La cellule est alimentée en saumure côté anode et en eau côté cathode.
Le séparateur des compartiments anodique et cathodique est constitué de membranes cationiques (perméable aux cations Na+) de 0,1 à 0,2 mm d’épaisseur. Ce sont des polymères perfluorosulfoniques (« Nafion » de Du Pont de Nemours) ou perfluorocarboxyliques (« Flemion » de Asahi Glass). Les cathodes sont en nickel, les anodes du type DSA. Les anodes DSA (Dimensionally Stables Anodes) sont de fines grilles en titane recouvertes d’oxydes de titane et ruthénium, la durée de vie de ce dépôt est de 5 à 8 ans.
La conductivité des membranes est faible et leur sélectivité est limitée par la concentration en NaOH. Actuellement la concentration maximale atteinte est de 30 à 35 % en NaOH, la soude ayant une teneur en NaCl inférieure à 50 ppm.
Cellules à diaphragme
Schéma de fonctionnement (sur le site Euro Chlor)
Elles utilisent directement du sel de dissolution qui est purifié pour éliminer les ions Ca2+ et Mg2+ susceptibles de former, lors de l’électrolyse, des hydroxydes qui colmateraient le diaphragme. Avant électrolyse, la saumure est traitée à l’aide d’hydroxyde de sodium et de carbonate de sodium pour éliminer, par précipitation, les ions Mg2+ sous forme d’hydroxyde et les ions Ca2+ sous forme de carbonate. Les ions métalliques présents (fer, titane, nickel, chrome, vanadium et molybdène) précipitent également sous forme d’hydroxydes. Dans certains cas, un traitement au carbonate ou au chlorure de baryum est mis en œuvre pour éliminer les ions sulfates. Les saumures destinées aux cellules à diaphragme doivent avoir les teneurs suivantes : Ca2+ < 2 mg/L, Mg2+ < 1 mg/L, ions sulfate < 5 g/L.
Le diaphragme est composé de fibres ; celles-ci étaient initialement en amiante, mais ont été remplacées par du PTFE (polytétrafluoréthylène) dans de nombreuses installations, particulièrement en France où cela est obligatoire depuis 2002. Il est changé après quelques années de fonctionnement. Les cathodes sont en grillage d’acier doux recouvert de nickel. Leur durée de vie est de 15 à 20 ans. Après électrolyse, la solution de soude (140 g/L de NaOH) contient également du NaCl (160 g/L) provenant de la saumure partiellement épuisée. La solution doit être concentrée par évaporation de l’eau (ce qui est coûteux en investissement et en énergie) au cours de laquelle NaCl cristallise, ce qui permet de le séparer de la solution et de le recycler. On obtient ainsi, une solution de NaOH à 50 % contenant de 1 à 2 g/L de NaCl. Le chlorure de sodium cristallisé récupéré peut être utilisé pour alimenter des cellules à membrane. Souvent, sur un même site de production, les procédés diaphragme et membrane sont utilisés en synergie de production/consommation de sel. L’électrolyse à diaphragme s’est surtout développée aux États-Unis.
Cellules à cathode de mercure
Elles utilisent, généralement, du sel cristallisé mis en solution saturée avec une concentration d’environ 320 g.L-1 de NaCl. Avant électrolyse, la saumure est purifiée afin d’atteindre les teneurs suivantes : Ca2+ < 2 mg/L, Mg2+ < 1 mg/L, ions sulfate < 5 g/L, comme dans le cas des cellules à diaphragme.
Chaque cellule de 10 à 30 m2 de surface sur 30 cm de hauteur peut contenir jusqu’à 250 plaques DSA (de 30×70 cm). Elles sont disposées parallèlement à la surface du mercure. Le mercure (3 à 4 t/cellule) jouant le rôle de cathode a une épaisseur de 3 mm et s’écoule à la vitesse de 1 m/s, la cuve étant inclinée. La distance entre les anodes et le mercure est de l’ordre de 5 mm. L’électrolyse est effectuée à une température de 85°C et le pH de la saumure se stabilise à environ 3,5. Il se forme un amalgame avec le mercure qui contient de 0,2 à 0,5 % de sodium.
Après électrolyse, la concentration de la saumure est d’environ 260 g.L-1 de NaCl. Elle est à nouveau concentrée par ajout de NaCl solide, l’électrolyse à cathode de mercure ne consommant pas d’eau dans la partie électrolyse. L’amalgame est décomposé, en présence d’eau déminéralisée, dans des tours ou des bacs d’acier remplis de morceaux de graphite imprégnés par un métal de transition (Fe, Ni ou Mo). Ce procédé donne, en général, de la soude exempte de NaCl, à une concentration de 50 %. Le dihydrogène formé est récupéré.
L’électrolyse à cathode de mercure est la technique industrielle la plus ancienne (elle date de 1888). Elle s’est surtout développée en Europe. Les capacités de production des usines sont de 50 000 à 300 000 t/an de dichlore. Une production de 250 000 t/an de Cl2 nécessite l’utilisation d’une centaine de cellules. Depuis 2018, la totalité des cellules à cathode de mercure a été, en Europe, remplacée par des cellules à membranes ou les usines ont été fermées.
Coproduits
NaOH : 1,13 t/t Cl2.
H2 : 28 kg/t Cl2. Ce dihydrogène est de haute pureté. Avec 240 000 t, Il est, en 2023, en Europe, à 85,1 % valorisé pour produire divers produits tels que le méthanol, le peroxyde d’hydrogène, l’acide chlorhydrique… ou utilisé comme combustible.
Pour caractériser les productions résultant de l’électrolyse des solutions aqueuses de chlorure de sodium on utilise l’ECU (Electro-Chemical Unit) qui correspond à 1,0 t de dichlore, 1,1 t d’hydroxyde de sodium et 0,03 t de dihydrogène.
Remarques :
- L’électrolyse de NaCl produit simultanément Cl2 et NaOH. La production est, en général, commandée par la demande en Cl2. NaOH est facile à stocker, exporter ou importer et peut être produit par d’autres voies (voir le chapitre hydroxyde de sodium).
- Par mesure de sécurité, chaque unité d’électrolyse est équipée d’une installation capable d’absorber, en cas de nécessité, le chlore gazeux en le transformant en hypochlorite de sodium. Cette installation permet de recueillir, dans un réseau de canalisations en légère dépression, les dégazages divers contenant ou pouvant contenir du dichlore puis de fixer ce dichlore dans des solutions de soude caustique diluée ruisselant au sein d’une ou plusieurs tours en série.
Problèmes
Cellules à diaphragmes : principalement liés aux risques, pour la santé humaine, lors de la manipulation de l’amiante, pendant son extraction et ses transformations. Des diaphragmes sans amiante sont de plus en plus utilisés, particulièrement en Europe, où une seule usine utilise des diaphragmes en amiante, celle de Dow, à Stade, en Allemagne. Par contre, aux États-Unis, de nombreuses cellules à diaphragme utilisent de l’amiante.
Cellules à mercure : elles entraînent une pollution par le mercure. Par exemple, en 2020, la quantité de mercure présente dans les produits (dichlore, NaOH et dihydrogène) fournis par les 11 usines d’Amérique du Nord et du Sud et de Russie, était de 211 kg/an, dans l’eau de 73 kg/an et dans l’atmosphère de 2 384 kg/an.
En Europe, en moyenne, les émissions totales de mercure (produits, eau et air) étaient, en 2017, de 0,68 g de Hg/t de Cl2, soit 1,4 t de mercure, elles étaient de 2,60 g de Hg/t de Cl2, en 1995. Il faut cependant noter que les émissions de l’industrie du chlore représentaient moins de 1 % des émissions globales de mercure dans l’air.
Il n’y a plus de projet, dans le monde, de construction d’usine à cathode de mercure. L’abandon quasi total de leur exploitation a eu lieu, en Europe, fin 2017. Fin 2016, la quantité de mercure stocké dans ces installations d’électrolyse était, dans l’Union européenne, de 5 344 t dans 33 unités qui ont été en grande partie démantelées avant fin 2017. En 2017, dans le monde, 30 usines, avec 2,64 millions de t/an de capacité de production de dichlore, fonctionnaient avec des cellules à cathodes de mercure et émettaient 4,5 t de Hg/an. Ce mercure stocké dans les sites de production de dichlore est sous forme liquide et est donc susceptible d’émettre de la vapeur de mercure particulièrement toxique. Divers projets sont en cours de développement pour transformer ce mercure liquide en forme solide, non émettrice de vapeur, en général en sulfure, le cinabre. Par exemple, la société Batrec, du groupe Véolia, à Wimmis, en Suisse, possède une capacité de traitement de 1 200 t/an, avec l’ajout de soufre dans le mercure liquide, dans 3 réacteurs et après réaction récupère le cinabre dans un filtre-presse, puis le stocke dans les mines souterraines de potasse allemandes de Herfa-Neurode, en Hesse, du groupe K+S. D’autres sociétés, Econ Industries, avec une unité mobile de traitement, Mayasa Spain, à Almadén, en Espagne et Remondis, à Dorsten, en Allemagne, interviennent dans cette activité.
En 2021, en Europe, 251 t de mercure ont été éliminées, il en reste, fin 2022, 79 t présentes encore dans les unités qui utilisaient des cellules à cathode de mercure.
Principales unités de production dans le monde
| Lieu | Société | Capacité totale, en milliers de t/an |
Capacité par types de cellules | ||
| Membrane | Diaphragme sans amiante | Diaphragme avec amiante | |||
| Freeport, Texas | Olin | 3 030 | 1 450 | 1 580 | |
| Stade, Allemagne | Dow | 1 624 | 600 | 1 024 | |
| Lake Charles, Louisiane | Westlake | 1 270 | 1 020 | 250 | |
| Mailiao, Taipei chinois | Formosa Plastics | 1 209 | 1209 | ||
| Plaquemine, Louisiane | Shin Etsu | 1 055 | 1 055 | ||
| Shin-Nanyo, Japon | Tosoh | 1 022 | 1 022 | ||
| Urumqi, Xinjiang | Xinjiang Zhongtai | 1 000 | 1 000 | ||
| Plaquemine, Louisiane | Olin | 971 | 971 | ||
| Point Comfort, Texas | Formosa Plastics | 910 | 910 | ||
| Shihezi, Xinjiang | Tianye Group | 910 | 910 | ||
Source : « Chlorine and building materials« , HBN
Conditionnement et transport
A la sortie des cellules d’électrolyse, Cl2 à 90°C est saturé en vapeur d’eau. Il est refroidi, ce qui entraîne la condensation de la majeure partie de la vapeur d’eau, au-dessus de 12°C, afin d’éviter la formation d’hydrate de chlore puis séché, avec une teneur résiduelle d’eau de moins de 20 ppm, avec de l’acide sulfurique concentré dans des tours à garnissage. Il est nécessaire de sécher le dichlore le plus tôt possible afin de pouvoir manipuler le gaz dans des installations en acier courant. En effet, en présence de dichlore sec, il se forme à la surface de l’acier une couche passive de chlorure de fer qui est très soluble dans l’eau.
Les réservoirs de stockage fixes (ainsi que les postes de chargement/déchargement) sont souvent équipés d’un réseau d’eau sous pression pouvant former, en cas de fuite de dichlore, un « rideau » d’eau autour de l’installation.
Le dichlore est comprimé et liquéfié pour le transport.
En 2023, 95,3 % de la production européenne est transformée et consommée sur place ou est transportée par pipeline local vers des utilisateurs voisins et 4,7 % transportée, à 80 % par chemin de fer. En Europe, seulement le Royaume Uni utilise la voie routière et avec des limites l’Espagne et le Portugal.
Recyclage
Le dichlore sert à produire de très nombreux composés qui en fin de vie, en particulier après incinération, donnent du chlorure d’hydrogène qui est récupéré, en solution aqueuse sous forme d’acide chlorhydrique. HCl gazeux peut, par le procédé Deacon ou par électrolyse de sa solution, redonner du dichlore (voir le début du chapitre fabrication industrielle).
Productions
Production mondiale, en 2017 : 70 millions de t. Le dichlore est fabriqué sur 488 sites de production, disséminés dans 85 pays.
Capacités de productions : monde, en 2021 : 90,35 millions de t/an, Union européenne, en 2023 : 11,212 millions de t/an.
| Chine (2016) | 34 300 | Japon (2012) | 3 800 | |
| États-Unis (2019) | 10 938 | Russie (2012) | 1 500 | |
| Allemagne (2023) | 5 345 | Corée du Sud (2012) | 1 500 | |
| Inde (2020) | 4 131 | France (2023) | 1 379 |
Source : Euro Chlor
En 2019, la production des États-Unis a été de 10,94 millions de t, celle du Japon, en 2017, de 3,543 millions de t, celle de l’Inde, en 2018-19, de 3,136 millions de t.
Commerce international : en 2024. Celui-ci est très limité du fait les risques liés au transport du dichlore. La production est très majoritairement utilisée sur les lieux de production ou des lieux proches.
Principaux pays exportateurs sur un total de 493 344 t.
| Canada | 168 691 | Slovaquie | 18 261 | |
| Mexique | 98 290 | Colombie | 16 067 | |
| France | 32 142 | Allemagne | 13 979 | |
| Thaïlande | 20 703 | États-Unis | 9 624 | |
| Belgique | 20 347 | Roumanie | 9 477 |
Source : ITC
Les exportations du Canada sont destinées quasi totalement aux États-Unis.
Principaux pays importateurs, sur un total de 550 570 t.
| États-Unis | 267 846 | Allemagne | 11 512 | |
| Belgique | 43 188 | Suisse | 10 316 | |
| Hongrie | 32 750 | Malaisie | 10 254 | |
| Philippines | 22 769 | Ukraine | 9 348 | |
| Pays Bas | 11 689 | Arabie Saoudite | 8 447 |
Source : ITC
Les importations des États-Unis proviennent à 63 % du Canada, 35 % du Mexique.
Principaux producteurs : capacités annuelles de production, en 2021.
| Olin (États-Unis) | 5 375 | Formosa Plastics Group (Taipei chinois) | 2 363 | |
| Westlake (États-Unis) | 3 279 | Covestro (Allemagne) | 2 063 | |
| Oxy (États-Unis) | 2 900 | Inovyn (Royaume Uni) | 1 817 | |
| Dow Chemical (États-Unis) | 2 376 | Nobian (Pays Bas) | 1 222 |
Sources : Olin et rapports des sociétés
- Olin, en octobre 2015, a acquis les activités de Dow Chemical dans les solvants chlorés dans le monde et les produits chlorovinyliques aux États-Unis. Les unités de production sont situées aux États-Unis, à Freeport, au Texas, avec 3,069 millions de t/an, Plaquemine, en Louisiane, avec 845 000 t/an, Saint Gabriel, en Louisiane, avec 246 000 t/an, Mc Intosh, dans l’Alabama, avec 578 000 t/an, Niagara Falls, dans l’État de New-York, avec 240 000 t/an, Charleston, dans le Tennessee, avec 218 000 t/an et au Canada, à Becancour, au Québec, avec 175 000 t/an. Après avoir réduit, en 2021, ses capacités de production avec diaphragme de 200 000 t/an à Mc Intosh et de 225 000 t/an à Plaquemine, Olin poursuit, pour fin 2022, une diminution de 225 000 t/an de production avec diaphragme, à Freeport, au Texas ainsi que 200 000 t/an de production avec diaphragme à Mc InTosh, dans l’Alabama.
- Westlake a acquis Axiall qui avait regroupé, en janvier 2013, les activités dans le dichlore de Georgia Gulf et PPG. Les unités de production de dichlore sont situées aux États-Unis au Kentucky, à Calvert City, avec 250 000 t/an, en Louisiane à Lake Charles, avec 1,27 million de t/an, à Plaquemine, avec 426 000 t/an et Geismar, avec 317 000 t/an, en Virginie Occidentale à Natrium, avec 227 000 t/an, dans l’État de Washington à Longview, au Canada, à Beauharnois, au Québec, avec 88 000 t/an et à Taipei chinois, à Kaohsiung, avec 60 % d’une joint venture. En Allemagne, produit du dichlore via sa filiale, Vinnolit, à Gendorf avec 205 000 t/an et Knapsack avec 250 000 t/an.
- OxyChem exploite des unités de production aux États-Unis dans le Kansas à Wichita, avec 248 000 t/an, en Louisiane à Convent, avec 353 000 t/an, Taft, avec 650 000 t/an et Geismar, avec 438 000 t/an, au Texas à Dee Park, avec 295 000 t/an, La Porte, avec 525 000 t/an et Ingleside, avec 570 000 t/an, dans l’État de New-York à Niagara Falls, avec 335 000 t/an, au Tennessee à New Johnsonville, avec 165 000 t/an. produit également du dichlore au Chili, à Talcahuano.
- Dow Chemical produit du dichlore dans l’Union européenne (voir ci-dessous) et au Brésil, à Aratu, dans l’État de Bahia.
- Formosa Plastics, possède des capacités de production de 717 273 t/an aux États-Unis à Point Comfort, au Texas et Baton Rouge, en Louisiane et de 366 700 t/an à Taipei chinois.
- Covestro produit du dichlore en Allemagne (voir ci-dessous), aux États-Unis, à Baytown, au Texas avec 363 000 t/an et en Chine à Shanghai, selon le procédé Deacon avec 320 000 t/an.
- Inovyn, société du groupe Ineos, produit du dichlore dans l’Union européenne (voir ci-dessous) et en Norvège, à Rafnes avec 280 000 t/an.
- Nobian est issue, en 2021, du groupe Nouryon.
Capacités de production dans l’Union européenne, au 1er janvier 2024 : 11,212 millions de t/an, dans 62 usines.
| Allemagne | 5 345 | Espagne | 516 | |
| France | 1 379 | Hongrie | 480 | |
| Belgique | 1 074 | Pologne | 405 | |
| Pays Bas | 847 | Italie | 357 |
Source : Euro Chlor
Production de l’Union européenne, en 2023, en milliers de t : total : 5 472, dont Allemagne : 2 693, en 2022, France : 847, Hongrie : 373, en 2021, Espagne : 322, Roumanie : 147, Portugal : 113, Italie : 17. Les productions de Belgique et des Pays Bas sont confidentielles.
Principaux producteurs européens, principaux sites et capacités de production : au 1er janvier 2023 et ( ) type de cellules utilisées. M : membranes, D : diaphragme, HCl : électrolyse de HCl.
| Dow Chemical (1 876) |
Stade (Allemagne) : 1 624 (D-M) Schkopau (Allemagne) : 253 (M) |
| Inovyn (1 537) |
Anvers (Belgique) : 500 (M) Jemeppe (Belgique) : 174 (M) Stenungsund (Suède) : 123 (M) Rheinberg (Allemagne) : 220 (D-M) Tavaux (France) : 370 (M) Rosignano (Italie) : 150 (M) |
| Covestro (1 380) |
Dormagen (Allemagne) : 480 (M-HCl) Leverkusen (Allemagne) : 390 (M) Uerdingen (Allemagne): 290 (M) Brunsbuttel (Allemagne) : 220 (HCl) |
| Nobian
(1 222) |
Bitterfeld (Allemagne) : 99 (M) Ibbenbüren* (Allemagne) : 82 (M) Frankfurt (Allemagne) : 283 (M) Botlek (Pays Bas) : 637 (M) Delfzijl (Pays Bas) : 121 (M) |
Source : Euro Chlor
* : Le site de Ibbenbüren, exploité par Nobian, est propriété d’une joint-venture avec Evonik.
Fin 2017, quasiment toutes les électrolyse à cathode de mercure de l’Union européenne ont été converties ou arrêtées. L’usine suédoise de Stenungsund, en Suède, encore en fonctionnement a été convertie en janvier 2019. Sur 21 usines utilisant des cellules à cathode de mercure début 2017, 7 ont été fermées et 14 converties.
En juillet 2015, les groupes Ineos et Solvay ont regroupé leurs activités dans les produits chlorovinyliques, au sein de la joint venture 50/50 Inovyn qui est devenue, en juillet 2016, propriété du seul groupe Ineos.
Covestro est issu, depuis septembre 2015, de Bayer qui détient 64 % de la société. Construit, à Tarragone, en Espagne une usine de dichlore destiné à la production de polyuréthane.
Situation française
Production de dichlore : 847 580 t, en 2023.
Commerce extérieur : en 2024.
Les exportations étaient de 32 142 t avec comme principaux marchés à :
- 35 % la Belgique,
- 24 % la Hongrie,
- 15 % la Suisse,
- 14 % l’Allemagne,
- 4 % le Sénégal.
Les importations s’élevaient à 3 956 t en provenance principalement à :
- 36 % d’Italie,
- 36 % des Pays Bas,
- 14 % d’Espagne,
- 10 % d’Allemagne.
Producteurs, sites et capacités : ( ) type de cellules utilisées. M : membranes, D : diaphragme, Na : production de sodium.
Dans 9 usines productrices par 7 sociétés.
| Vencorex | Pont de Claix (38) : 118 (M) |
| Métaux spéciaux (MSSA) | Plombières (73) : 42 (Na) |
| Vynova PPC | Thann (68) : 42 (M) |
| Kem One | Fos (13) : 178 (D) – 155 (M) Lavera (13) : 341 (M) |
| Arkema | Jarrie (38) : 75 (M) Saint Auban (04) : 20 (M) |
| Kuhlmann (Tessenderlo) | Loos (59) : 38 (M) |
| Inovyn | Tavaux (39) : 370 (M) |
- Vencorex, joint venture formée en 2012, entre PTT Global Chemical, groupe thaïlandais et Perstorp, groupe suédois est devenu, mi-2022, propriété du seul groupe PTT Global. Depuis septembre 2024, la société est en redressement judiciaire et cherche un repreneur.
- Arkema a annoncé, en janvier 2025, l’arrêt à Jarrie (38) de la production de dichlore suite à la fin de son approvisionnement en chlorure de sodium par Vencorex.
- Vynova PPC ex Potasse et Produits Chimiques est une filiale du groupe International Chemical Investors. En 2015, les cellules à mercure ont été converties en cellules à membrane.
- Kem One a converti les cellules d’électrolyse de l’usine de Lavéra, en cellules à membrane, depuis mars 2017.
- Début 2014, Arkema a converti ses cellules d’électrolyse au mercure, en cellules à membrane.
- Kuhlmann, ex Produits chimiques de Loos (Tessenderlo) a converti les cellules à mercure en cellules à membrane avec une capacité de production augmentée à 38 000 t/an de dichlore.
Usines françaises
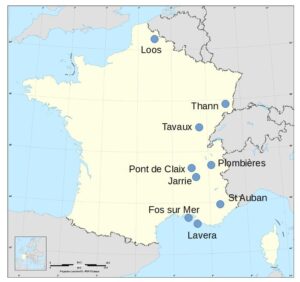
Utilisations
Consommations : monde, en 2016, 70 millions de t, selon la répartition suivante, en 2019 : à 45 % en Chine, 17 % aux États-Unis, 12 % en Europe de l’Ouest, 5 % au Japon, 4 % dans le sous-continent indien.
France, en 2016 : 822 560 t.
Secteurs d’utilisation du dichlore
En 2023, en Europe, sur un total de 7,289 millions de t. Source : Euro Chlor
Secteurs d’utilisation : en 2023, en Europe.
| PVC | 32,0 % | Autres produits organiques | 8,8 % | |
| Isocyanates et oxygénates | 30,7 % | Solvants, épichlorhydrine, chlorométhanes et divers | 12,8 % | |
| Produits inorganiques | 15,6 % |
Source : Euro Chlor
Dans le monde, en 2017, le PVC représente 33 % de la consommation, les autres produits organiques, 21 %, le traitement de l’eau, 7 %, les intermédiaires chlorés, 6 %, la pâte à papier, 2 %, les autres produits inorganiques, 2 %.
La chimie organique absorbe plus de 80 % du dichlore produit.
Le dichlore est utilisé dans la fabrication de très nombreux produits chimiques et dans le commerce, on trouve plus de 15 000 produits chlorés.
85 % des produits pharmaceutiques fabriqués dans le monde utilisent du dichlore ou contiennent l’élément chlore.
96 % des produits phytosanitaires contiennent l’élément chlore.
Polymères contenant du chlore : le PVC : 57 % de sa masse est constituée par l’élément chlore. Il est obtenu par polymérisation du chlorure de vinyle monomère (CVM). Les unités de CVM sont implantées, en général, sur des sites produisant Cl2 et de l’éthylène (voir le chapitre PVC) ; le chlorure de polyvinylidène (CPVD), le polysulfure de phénylène, des élastomères synthétiques…
Polymères exempts de chlore : de nombreux autres polymères ne contiennent pas de chlore mais utilisent pour leur synthèse des produits élaborés à partir du dichlore, ce qui correspond à 20-25 % des consommations de dichlore.
- les polyuréthanes sont préparés à l’aide d’oxyde de propylène et d’isocyanate obtenu à partir de phosgène (COCl2),
- les polycarbonates utilisent le phosgène,
- les résines époxy emploient l’épichlorhydrine (CH2CHOCH2Cl),
- les polymères fluorés (polytétrafluoroéthylène (PTFE) connus sous le nom de marques déposées : Teflon, Hostaflon…) utilisent du chloroforme (CHCl3).
Synthèse du titane, du silicium et de la méthylcellulose.
Solvants chlorés : on assiste à une diminution importante de la consommation de chlore dans ce secteur (voir ce chapitre).
Pâte à papier : Cl2 est utilisé, particulièrement aux États-Unis et au Canada, comme agent de blanchiment des pâtes chimiques. Il forme des chlorolignites solubles dans la soude. Il est de plus en plus concurrencé par le chlorate de sodium, le peroxyde d’hydrogène et le dioxygène. En France, le dichlore n’est plus utilisé dans ce secteur depuis 1995.
Désinfection de l’eau potable : la désinfection finale est effectuée à l’aide de Cl2, à raison de 0,1 mg/L d’eau. Le traitement par le dichlore, au cours de traitement de l’eau, est, en général, effectué après élimination des composés organiques susceptibles de former des composés organochlorés (voir les chapitres eau et eau de Javel), sauf lors de traitements de choc en cas d’urgence. On estime que l’eau non purifiée est responsable de 25 000 morts par jour dans le monde.
Sécurité
Risques liés à l’inhalation du dichlore par voie respiratoire.
Employé comme gaz de combat lors de la 1ère guerre mondiale (la première fois le 22 avril 1915).
Au contact de la muqueuse rhino-pharyngée, le dichlore provoque un réflexe inhibiteur cardiorespiratoire avec bradycardie (ralentissement du cœur) et arrêt respiratoire à glotte fermée si l’intoxication est massive. Par ailleurs, pour toute inhalation importante, un œdème aigu du poumon est à redouter.
Effets de diverses concentrations, en ppm en volume :
- 0,25 ppm : seuil de perception olfactif,
- 5 ppm : légère irritation du nez et des voies aériennes supérieures,
- 15 à 20 ppm : irritation grave des voies aériennes supérieures, toux intense et suffocation,
- au-dessus de 50 ppm : perte de conscience et décès.
L’exposition à ce gaz ne doit donc pas excéder 0,5 ppm (valeur moyenne limite d’exposition (VME)).
Bibliographie
- Documents et statistiques du Syndicat des Halogènes et dérivés, Le Diamant A, 92909 Paris la Défense Cedex.
- Euro Chlor, rue Belliard 40, bos 15, B-1040 Bruxelles, Belgique.
- World Chlorine Council, 700 2nd Street, NE, Washington, DC 20002 États-Unis.
- J. Vallette, « Chlorine and building materials« , HBN, juillet 2018 et mars 2019.
- BAT Reference document for the production of chlor-alkali, European Commission, 2014.
- « Le chlore », 4ème édition, Syndicat des Halogènes et dérivés, octobre 1996.
- Livre blanc du chlore, éditeur : Jules Houtmeyers, président de Belgochlor, novembre 2004.
Archives