L’acide sulfurique est élaboré essentiellement selon le procédé de contact par oxydation du soufre ou du dioxyde de soufre provenant du grillage de minerais sulfurés.
Données physico-chimiques
Données atomiques
| Formule | Masse molaire | Moment dipolaire |
| H2SO4 | 98,08 g.mol-1 | 2,72 D |
Données physiques
| Masse volumique | Température de fusion | Température d’ébullition de l’acide à 98,3% (azéotrope) | Solubilité dans l’eau |
| 1,84 g.cm-3 | 10,36°C | 338°C | infinie |
Données chimiques
| pKa : H2SO4/HSO4– | pKa : HSO4– /SO42- |
pKs : Ag2SO4 |
pKs : BaSO4 | pKs : CaSO4 | pKs : Hg2SO4 | pKs : PbSO4 | pKs : RaSO4 | pKs : SrSO4 |
| -3,0 | 1,9 | 4,8 | 10 | 5,9 | 6,3 | 7,8 | 14 | 6,5 |
Potentiels standards :
| SO42- + 4H+ + 2e = H2SO3 + H2O | E° = 0,17 V |
| SO42- + H2O + 2 e = SO32- + 2OH– | E° = -0,93 V |
| S2O82- + 2e = 2SO42- | E° = 2,0 V |
| 2SO42- + 4H+ + 2e = S2O62- + 2H2O | E° = -0,2 V |
Données thermodynamiques
Acide sulfurique liquide
|
|
Données industrielles
L’acide sulfurique, appelé jadis huile de vitriol ou vitriol, est un composé chimique de formule H2SO4. C’est un acide fort complétement dissocié en solution aqueuse selon la réaction suivante :
H2SO4 + 2 H2O = 2 H3O+ + SO42-
Concentré, il est livré le plus souvent à une teneur de 96 %. Les statistiques sont généralement données en H2SO4 à 100 %.
Matières premières
Soufre (voir ce chapitre) ou dioxyde de soufre (voir ce chapitre).
En 2020, dans le monde, l’origine du soufre utilisé a été la suivante :
| Soufre élémentaire | 61 % | Grillage de pyrites et autres | 9 % | |
| Grillage de minerais de cuivre, zinc et nickel | 30 % |
Le soufre élémentaire provient principalement de la désulfuration du gaz naturel et du pétrole mais aussi marginalement de soufre natif, par exemple en Pologne. Lors du grillage des minerais de cuivre, de zinc et de nickel, le dioxyde de soufre produit est transformé en acide sulfurique. De même pour le grillage de pyrites, voir le chapitre soufre.
Fabrication industrielle
Essentiellement par le procédé de contact.
En général, le processus est en 3 étapes.
Première étape : fabrication de SO2.
Par combustion, entre 900 et 1100°C, du soufre liquide divisé en fines gouttelettes dans de l’air sec en excès :
S + O2 = SO2 ΔrH°298 = – 297 kJ/mole
Le mélange gazeux après combustion a une teneur de 8 à 12 % en volume de SO2 et sa purification n’est pas nécessaire.
Le grillage de sulfures métalliques (voir les chapitres consacrés au zinc et au plomb) donne directement du dioxyde de soufre.
Deuxième étape : formation de SO3 par le procédé de contact ou procédé Bayer.
L’oxydation de SO2 est réalisée par le dioxygène de l’air, à 410-440°C, en présence de catalyseurs :
SO2 + 1/2 O2 = SO3 ΔrH°298 = – 99 kJ/mole
L’oxydation étant exothermique, la réaction amorcée à environ 430°C atteint rapidement 600°C. Avant introduction dans le lit de catalyseur suivant, le gaz formé est refroidi à 430°C.
Le catalyseur (de l’ordre de 80 t par réacteur) est constitué de kieselguhr (diatomite) imprégné d’un mélange de VOSO4 et KHSO4 qui donne V2O5 lors de l’oxydation de SO2. Les ions K+ sont actuellement remplacés, partiellement, par des ions Cs+.
L’oxydation a lieu par passage à travers 4 ou 5 lits de catalyseur montés en série :
- Par simple contact : 60 % du SO2 est oxydé après le 1er lit, 90 % après le 2ème, 98 % après le 4ème. Ensuite le SO3 formé, refroidi à 200°C, est absorbé dans de l’acide sulfurique à 98,5 % (voir ci-dessous).
- Par double contact : une amélioration du procédé Bayer consiste à réaliser une double absorption. Après le 2ème ou le 3ème lit, le SO3 formé est absorbé dans H2SO4 à 98,5 %. Le gaz restant est chauffé à 480°C puis passe à travers un 3ème, 4ème ou 5ème lit. Le rendement final est supérieur à 99,6 %. Ce procédé permet de réduire à 350 ppm la teneur en SO2 du gaz rejeté dans l’atmosphère.
La teneur en dioxyde de soufre des gaz rejetés peut être diminuée, jusqu’à 15 ppm, en utilisant le procédé sulfacid qui consiste à traiter les gaz produits, en présence d’eau, par adsorption sur du charbon actif. On obtient de l’acide sulfurique dilué, avec une concentration comprise entre 10 et 20 %, qui peut être recyclé. Ce procédé est utilisé par l’OCP pour deux de ses unités de production d’acide sulfurique, à Jorf Lasfar et Safi, au Maroc.
La production de H2SO4 à partir de soufre génère de l’énergie avec 5,7 GJ/t de H2SO4 à 100 %. Environ 60 % de cette énergie est utilisée pour produire de la vapeur d’eau.
Troisième étape : formation de H2SO4.
SO3 + H2O = H2SO4 ΔrH°298 = – 132,4 kJ/mole
SO3 se dissout difficilement dans l’eau mais par contre il est soluble dans l’acide sulfurique concentré en donnant des oléums. L’acide commercial à 78, 96 ou 98 % est obtenu par dilution des oléums formés.
Les unités de production ont des capacités qui peuvent atteindre 5 000 t/jour avec par exemple les deux unités de production de l’OCP, à Jorf Lasfar, au Maroc.
Pour produire 1 000 t de H2SO4 à 100 %, il faut environ :
| Soufre | Eau | Air | Électricité |
| 338 t | 2 500 m3 | 3 millions de m3 | 45 000 kWh |
Évolution de la production selon les procédés : en France, en milliers de t de H2SO4 à 100 %.
L’ancien procédé, aux chambres de plomb, a été supplanté par le procédé de contact.
| Année | Production | Chambres de plomb | Procédé de contact |
| 1954 | 1 378 | 55 % | 45 % |
| 1970 | 3 596 | 11 % | 89 % |
| 1974 | 4 577 | 6 % | 94 % |
| 1975 | 3 664 | 5 % | 95 % |
| 1979 | 4 848 | 1 % | 99 % |
| 1991 | 3 080 | ||
| 1996 | 2 566 | 0 | 100 % |
| 2010 | 750 | 0 | 100 % |
| 2020 | 526 | 0 | 100 % |
La diminution de la production française a été principalement liée à l’arrêt de la production d’acide phosphorique et d’engrais phosphatés, la dernière usine ayant fermé en 2004.
Productions
En 2019, la production mondiale a été de 281 millions de t, celle de l’Union européenne, en 2023, de 14,603 millions de t.
Estimation des productions dans les principaux pays, en 2017 :
| Chine, en 2021 | 93 800 | Maroc | 7 000 | |
| États-Unis | 40 000 | Japon, en 2021 | 6 118 | |
| Inde | 16 000 | Allemagne, en 2022 | 2 949 | |
| Russie | 14 000 |
Sources : Eurostat, Statistics Bureau of Japan
En Inde, en 2018, il y a 65 usines de production.
Productions, en 2023, dans l’Union européenne sur un total de 14,603 millions de t.
| Allemagne, en 2022 | 2 949 | Italie | 819 | |
| Finlande | 2 109 | Suède, en 2022 | 595 | |
| Espagne | 2 031 | France | 578 | |
| Pologne | 1 381 | Autriche | 495 | |
| Belgique | 1 273 | Serbie | 421 |
La production de la Bulgarie, producteur important, est confidentielle.
Commerce international : en 2024.
Le commerce mondial avec environ 20 millions de t/an est limité, par rapport à la production, car les utilisateurs, en particulier les producteurs d’engrais phosphatés, produisent eux-même, en grande partie, l’acide en important du soufre.
Principaux pays exportateurs.
| Japon | 3 437 | Bulgarie | 1 128 | |
| Chine | 2 683 | Mexique | 1 061 | |
| Corée du Sud | 2 452 | Allemagne | 1 032 | |
| Canada | 1 746 | Belgique | 658 | |
| Pérou | 1 147 | Russie | 542 |
Les exportations japonaises sont destinées à 39 % aux Philippines, 15 % à l’Inde, 14 % au Chili, 9 % à l’Indonésie.
Principaux pays importateurs sur un total mondial de 21,626 millions de t.
| Chili | 3 614 | Indonésie | 1 083 | |
| États-Unis | 3 482 | Turquie | 882 | |
| Inde | 1 785 | Arabie Saoudite | 762 | |
| Maroc | 1 711 | Thaïlande | 626 | |
| Philippines | 1 417 | Kazakhstan | 592 |
Les importations chiliennes proviennent à 34 % de Chine, 31 % du Pérou, 13 % de Corée du Sud, 12 % du Japon, 6 % du Mexique.
Producteurs :
Les principaux producteurs sont d’une part les producteurs d’engrais phosphatés, (Office Chérifien des Phosphates (OCP), Mosaic, Nutrien, PhosAgro, Eurochem, Groupe Chimique Tunisien (GCT)) ainsi que les groupes chimiques pour leurs propres besoins et d’autre part les groupes métallurgiques produisant du cuivre, du zinc, du plomb, du nickel… à partir de minerais sulfurés.
Les producteurs d’engrais et les groupes chimiques auto-consomment, en général, l’acide produit, alors que les groupes métallurgiques sont les principaux pourvoyeurs d’acide sur le marché. Par exemple :
- Le groupe Glencore produit de l’acide sulfurique, au Canada, à partir du grillage de minerais sulfurés de cuivre, nickel, plomb et zinc. La commercialisation de l’acide produit en Ontario à Sudbury INO lors du grillage de minerais de nickel et de cuivre, au Québec lors du grillage de minerai de cuivre avec la Fonderie Horne à Rouyn-Noranda qui produit 640 000 t/an d’acide et lors du grillage de minerai de zinc avec l’affinerie CEZinc à Salaberry de Valleyfield qui produit 400 000 t/an d’acide est assurée par Norfalco, filiale de Glencore, avec 2 millions de t/an.
- En Europe, les principaux producteurs sont : Aurubis avec 2,296 millions de t en 2021-22, en Allemagne à Hambourg et en Bulgarie, à Pirdop, Acideka, en Espagne, Nuova Solmine, en Italie, à Scarlino avec 600 000 t/an et Serravalle Scriva avec 75 000 t/an d’acide régénéré, Boliden, avec une capacité de production de 1,7 million de t/an à Rönnskar, en Suède, Harjavalta et Kokkola en Finlande et Odda, en Norvège, BASF, en Allemagne à Ludwigshafen et en Belgique à Anvers, avec, en 2016, 920 000 t/an de capacité mondiale de production d’acide sulfurique, Ineos, Prayon, en Belgique.
Recyclage
H2SO4 régénéré est obtenu à partir d’acide résiduaire ou de dérivés soufrés provenant des industries chimiques et parachimiques. Cet acide provient principalement des unités d’alkylation utilisées pour produire de l’essence sans plomb dans lesquelles l’acide sulfurique sert de catalyseur mais aussi des unités de sulfonation, du séchage et de la purification des gaz… L’acide utilisé est régénéré puis recyclé.
Parmi l’acide recyclé, il faut prendre en compte celui employé par l’hydrométallurgie de minerais (cuivre, zinc…). Dans ce cas, l’acide est directement recyclé sans régénération.
Principe de la régénération : l’acide, en présence d’air, de soufre et de fuel est craqué dans un four vers 1000°C et transformé en SO2. Le gaz produit est lavé à l’acide sulfurique dilué, filtré et séché à l’acide sulfurique à 93 % puis, le SO2 est oxydé par conversion catalytique en SO3 qui dans une tour d’absorption donne l’acide sulfurique.
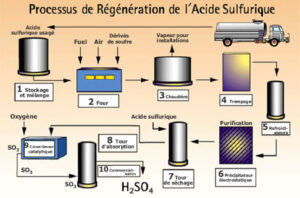
Document Rhodia Eco Services
L’acide régénéré est proposé à un prix compétitif en regard des coûts alternatifs de neutralisation et de mise en décharge des acides usés.
En 2012, la production d’acide régénéré, aux États-Unis, se situe entre 2,5 et 5 millions de tonnes.
Producteurs d’acide régénéré :
EcoServices, ex-Rhodia et Solvay, société du groupe PQ Corporation, est le premier producteur mondial d’acide sulfurique régénéré. Les unités de production d’acide sulfurique, qui représentent plus de la moitié des capacités de production du pays, sont toutes situées aux États-Unis, à Hammond dans l’Indiana, Bâton Rouge en Louisiane, Baytown et Houston au Texas, Dominguez et Martinez en Californie. La production est de plus d’un million de tonnes d’acide sulfurique régénéré par an.
Aux États-Unis, Veolia, exploite une usine de régénération d’acide sulfurique à Darrow, en Louisiane et des unités sur des sites pétroliers, à Delaware City, dans le Delaware, El Paso au Texas et Elizabeth dans le New Jersey.
En France, Adisseo, exploite une unité de régénération sur son site des Roches de Condrieu (38).
Situation française
Production : 578 195 t, en 2023.
Commerce extérieur : en 2024.
Les exportations étaient de 139 579 t avec comme principaux marchés à :
- 63 % la Belgique,
- 15 % l’Espagne,
- 6 % l’Algérie,
- 5 % l’Allemagne.
Les importation s’élevaient à 303 332 t en provenance principalement à :
- 34 % d’Allemagne,
- 25 % de Belgique,
- 20 % d’Espagne,
- 10 % d’Italie.
Producteurs et unités de production :
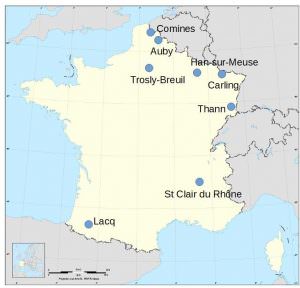
- Adisseo, filiale du groupe chinois Bluestar, à Saint Clair du Rhône (38), pour la production de méthionine (voir le chapitre sulfate de sodium), avec une capacité de production de 250 000 t/an.
- Nyrstar, à Auby (59), provenant du grillage de minerais de zinc (voir le chapitre zinc), avec une capacité de production de 200 000 t/an et une production, en 2018, de 167 000 t.
- Arkema, à Carling/Saint Avold (57), avec une capacité de production de 190 000 t/an et à Lacq/Mourenx (64).
- WeylChem Lamotte, à Trosly-Breuil (60), avec une capacité de production de 130 000 t/an.
- Tronox qui a acquis, en février 2017, les activités de la société Cristal, dans la production de dioxyde de titane à Than (68), avec une capacité de production de 86 000 t/an.
- Venator Pigments France à Comines (59), société issue du groupe Huntsman, qui synthétise des pigments bleus d’outremer avec une capacité de production inférieure à 10 000 t/an.
- Innospec Performance Chemicals à Han-sur-Meuse (55) avec une capacité de production de l’ordre de 3 000 t/an.
Localisation des usines françaises de production d’acide sulfurique
Utilisations
Consommation : en 2021, la consommation mondiale est de 287,7 millions de t avec, en 2020, la répartition suivante :
| Chine continentale | 35 % | Amérique latine | 7 % | |
| Amérique du Nord | 13 % | Europe de l’Est | 7 % | |
| Afrique | 12 % | Moyen Orient | 6 % |
Source : IHS Markit
Secteurs d’utilisation : dans le monde, en 2020.
| Engrais phosphatés | 57 % | Extraction de métaux | 8 % | |
| Produits chimiques | 13 % |
Utilisations diverses :
- L’industrie des engrais pour la fabrication de l’acide phosphorique (voir le chapitre consacré aux engrais phosphatés).
- La fabrication de l’acide phosphorique pour l’élaboration de phosphates destinés à l’alimentation animale ou humaine et de tripolyphosphates utilisés dans les détergents (voir le chapitre consacré à l’acide phosphorique).
- La fabrication du dioxyde de titane selon le procédé sulfurique. TiO2 est le principal pigment blanc utilisé dans les peintures.
- L’hydrométallurgie du zinc et du cuivre.
- La fabrication du caprolactame, du polyamide utilisés comme textiles.
- Le traitement de la pâte à papier.
- La fabrication de l’acide fluorhydrique.
- L’alkylation pour la production d’essence sans plomb.
- Pour le séchage et la purification des gaz.
- Pour le détartrage. Par exemple, le détartrage des 2,4 km2 d’aéroréfrigérants à tirage naturel des centrales électriques thermiques classiques ou nucléaires nécessite de 10 à 20 t/jour d’acide sulfurique à 98 %.
- La fabrication du papier sulfurisé par trempage de papier buvard dans de l’acide concentré. Les fibres sont partiellement solubilisées en formant un gel de cellulose qui précipite en bouchant les pores.
- Comme additif alimentaire, E 513, sous forme diluée.
- Le décapage des métaux.
- Comme électrolyte des batteries au plomb.
- Pour la production de TNT, de nitroglycérine, d’acide picrique et autres acides minéraux.
- Dans le traitement des eaux.
Risques et précautions d’emploi
Les principaux risques sont les suivants :
- L’acide sulfurique provoque des brûlures de la peau et des lésions oculaires graves avec risque de perte de la vue. Les risques sont d’autant plus importants que l’acide est concentré.
- Il peut irriter les voies respiratoires.
- En cas d’ingestion il peut entraîner des lésions de la bouche, de l’œsophage et du tube digestif. Il y a risque de perforation pour l’œsophage et l’estomac.
L’acide sulfurique réagit violemment avec l’eau avec un dégagement de chaleur important qui peut localement porter l’eau à ébullition. Cela peut se produire lorsque de l’eau est versée sur de l’acide concentré. L’eau étant moins dense que l’acide, la réaction se produit en surface et peut entraîner des projections d’acide. Pour cette raison, pour diluer de l’acide sulfurique, il faut toujours verser l’acide dans l’eau et non l’inverse. L’acide, plus dense, sa densité par rapport à l’eau est de 1,84, coule au fond du récipient et la réaction exothermique a lieu au sein du liquide au lieu de sa surface et les projections sont évitées.
Il réagit également violemment avec de nombreux composés et en particulier avec les cristaux de permanganate de potassium. Pour préparer une solution acide de permanganate de potassium, il faut au préalable dissoudre les cristaux de permanganate dans l’eau puis ensuite introduire l’acide sulfurique. Ne jamais mettre en contact les cristaux de permanganate avec l’acide concentré, il y a risque d’explosion violente.
Bibliographie
- Association des Entreprises de la Chimie Minérale (Adechim), France Chimie, Le Diamant A, 92909 Paris la Défense Cedex.
- « Sulfuric acid supply/demand fundamentals », Glencore, 22 mai 2017.
- European Sulphuric Acid Association (ESA), Av. van Nieuwenhuyse, 4/2, B-1160 Bruxelles, Belgique.
- Sulfuric Acid on the WebTM.
- International Fertilizer Industry Association (IFA), 15 rue Marbeuf, 75008 Paris.
- INRS, Fiche toxicologique n°30 : Acide sulfurique.