Le chlorure d’hydrogène peut être produit par synthèse directe entre le dichlore et le dihydrogène, mais l’origine principale du chlorure d’hydrogène est une coproduction lors de diverses réactions chimiques et lors de la combustion de composés chlorés. On considère que 40 procédés industriels génèrent comme co-produit du chlorure d’hydrogène.
Données physico-chimiques
Données atomiques
| Formule | Masse molaire | Distance interatomique | Moment dipolaire |
| HCl | 36,46 g.mol-1 | 127,4 pm | 1,1086 D |
Données physiques
| Masse volumique | Température de fusion | Température d’ébullition | Température critique | Pression critique | Température point triple | Pression point triple | Conductibilité thermique | Solubilité dans l’eau |
|
-88,5°C | -67,0°C | 51,35°C | 8 260 kPa | -114°C | 13,8 kPa | 13,16 W.m-1K-1 |
|
Données chimiques
| pKa : HCl/Cl– |
E° : Cl2(g) + 2e = 2Cl– |
pKs : AgCl |
pKs : CuCl | pKs : Hg2Cl | pKs : PbCl2 | pKs : TlCl |
| -7 | 1,358 V | 9,7 | 6,7 | 17,9 | 4,7 | 3,7 |
Données thermodynamiques
Chlorure d’hydrogène gazeux
|
|
Données industrielles
Le chlorure d’hydrogène est, dans les conditions normales, gazeux. Sa dissolution dans l’eau donne l’acide chlorhydrique. La concentration de l’acide est limitée par la solubilité du chlorure d’hydrogène dans l’eau soit, à 20°C, 720 g/L. En solution aqueuse, le chlorure d’hydrogène est totalement dissocié, l’acide chlorhydrique étant un acide fort, selon :
HCl(g) + H2O(l) = H3O+(aq) + Cl–(aq)
Du chlorure d’hydrogène est présent dans les éruptions volcaniques (de 0,5 à 11 millions de t de HCl/an). Par exemple, lors de son éruption de juin 1991, le Pinatubo, dans les Philippines, a émis de 0,5 à 5 millions de t de HCl dans l’atmosphère.
La production de HCl par l’organisme humain donne à l’estomac son pH acide, compris entre 1 et 2.
Fabrication industrielle
Le chlorure d’hydrogène peut être produit par synthèse directe entre le dichlore et le dihydrogène, cela représente environ 15 % de la production mondiale, mais l’origine principale du chlorure d’hydrogène est par coproduction lors de diverses réactions chimiques et lors de la combustion de composés chlorés. On considère que 40 procédés industriels génèrent comme co-produit du chlorure d’hydrogène.
Synthèse
Celle-ci à un coût de revient plus élevé que la coproduction mais elle donne du chlorure d’hydrogène plus pur, réservé à des utilisations dans l’élaboration de produits alimentaires et pharmaceutiques. La synthèse est réalisée par combustion du dichlore avec le dihydrogène, la température atteinte, 2500°C, nécessitant l’emploi de brûleurs en graphite.
H2(g) + Cl2(g) = 2 HCl(g)
La réaction a lieu en présence d’un excès de dihydrogène afin d’être sûr que tout le dichlore a réagi, car le mélange des deux gaz est explosif. L’électrolyse du chlorure de sodium en solution aqueuse donne du dichlore mais aussi du dihydrogène de grande pureté qui peut être utilisé pour la synthèse du chlorure d’hydrogène de qualité alimentaire. Ainsi, 95 % des unités de synthèse de HCl utilisent le dichlore et le dihydrogène produits par électrolyse du chlorure de sodium.
En 2012, aux États-Unis, la synthèse de HCl a représenté 6 % de la consommation de dichlore et, en 2016, la production de chlorure d’hydrogène est réalisée à 25 % par synthèse et 75 % par coproduction.
Coproduction lors de la formation de composés organiques chlorés
Chloration des composés aliphatiques par substitution et formation de solvants chlorés ou d’intermédiaires chimiques (voir le chapitre solvants chlorés) :
CH4 + n Cl2 = CH4-nCln + n HCl
Chloration des composés aromatiques (benzène, toluène) par substitution : en particulier lors de la production de monochlorobenzène pour la fabrication du phénol (voir ce chapitre) et de l’aniline.
Ar-H + Cl2 = Ar-Cl + HCl
Fabrication du chlorure de vinyle monomère destiné à la fabrication, par polymérisation, du PVC (voir le chapitre PVC) : la chloration de l’éthylène donne du 1,2-dichloroéthane qui par craquage se décompose en chlorure d’hydrogène et chlorure de vinyle :
C2H4 + Cl2 = C2H4Cl2
C2H4Cl2 = C2H3Cl + HCl
Toutefois, le chlorure d’hydrogène coproduit est recyclé pour produire à nouveau du 1,2-dichloroéthane, par oxychloration :
C2H4 + 2 HCl + 1/2 O2 = C2H4Cl2 + H2O
En conséquence, bien que du chlorure d’hydrogène soit coproduit, il est, en général, consommé par les unités productrices. Pour cette raison, les principaux producteurs de chlorure d’hydrogène sont les principaux producteurs de PVC.
Fabrication du diisocyanate de diphénylméthane (MDI) et du diisocyanate de toluène (TDI) destinés à la production de polyuréthane : le TDI est obtenu par réaction entre le diaminotoluène (ou 2-méthylbenzène-1,4-diamine) et le phosgène qui donne du diisocyanate de toluène et du chlorure d’hydrogène selon l’équation suivante :
CH3C6H3(NH2)2 + 2 COCl2 = CH3C6H3(NCO)2 + 4 HCl
Fabrication de silicones : la réaction du chlorure de méthyle (CH3Cl) avec le silicium, en présence de catalyseurs (dérivés de cuivre), donne, principalement, du diméthyldichlorosilane, (CH3)2SiCl2. L’hydrolyse de ce dernier donne du diméthylsilanediol, (CH3)2Si(OH)2 et du chlorure d’hydrogène.
(CH3)2SiCl2 + 2 H2O = (CH3)2Si(OH)2 + 2 HCl
Le chlorure d’hydrogène formé peut être récupéré pour donner avec du méthanol, à nouveau du chlorure de méthyle (voir le chapitre solvants chlorés), matière première de base pour la fabrication des silicones, selon la réaction suivante :
CH3OH + HCl = CH3Cl + H2O
Coproduction lors de la formation de composés minéraux
Sulfate de sodium : le sulfate de sodium peut être fabriqué par réaction, dans des fours Mannheim, à 500-600°C, entre l’acide sulfurique concentré et le chlorure de sodium selon la réaction :
2 NaCl + H2SO4 = Na2SO4 + 2 HCl
Le sulfate de sodium est extrait également de gisements naturels et co-produit lors de diverses fabrications chimiques.
Il est destiné à la fabrication de la pâte à papier, du verre, des lessives (voir le chapitre sulfate de sodium).
Sulfate de potassium : le sulfate de potassium peut être obtenu par action de l’acide sulfurique concentré sur du chlorure de potassium dans des fours Mannheim, à 800°C, selon la réaction :
2 KCl + H2SO4 = K2SO4 + 2 HCl
La production d’une tonne de sulfate de potassium entraîne la coproduction de 1,2 t de chlorure d’hydrogène.
Ce procédé est utilisé pour 50 à 60 % des capacités mondiales de production de sulfate de potassium. Par exemple, Tessenderlo Group, 3ème producteur mondial possède, à Ham, en Belgique, des capacités de production de 750 000 t/an de sulfate de potassium. Ce procédé, à prix de revient élevé, ne peut être intéressant que si le chlorure d’hydrogène co-produit, transformé en acide chlorhydrique, est valorisé.
D’autres procédés extraient le sulfate de potassium de mines de potasse ou de lac salés.
Il est destiné à la fertilisation de sols salés ou à la culture de plantes sensibles aux ions chlorures (voir le chapitre sulfate de potassium).
Incinération de résidus chlorés
La fabrication de dichloroéthane, chlorure de vinyle monomère, chlorométhanes et solvants chlorés, donne des résidus chlorés. L’incinération, à 1 200°C, de ces résidus, donne de l’acide chlorhydrique de qualité commerciale (à 33 %) qui est recyclé ou commercialisé. Par exemple, la capacité totale de traitement de l’atelier VRC (Valorisation de Résidus Chlorés) du site Arkema de Saint-Auban (04) est de 25 000 t/an.
L’incinération des PCB (polychlorobiphényls ou pyralène) donne également du HCl. Par exemple, le groupe Séché Environnement, à Saint-Vulbas (01) produit ainsi 3 500 t/an de HCl.
Depuis 2021, la société belge Indaver a construit, à Loon-Plage, près de Dunkerque, une usine de traitement de résidus chlorés, principalement issus de l’industrie du PVC, avec une capacité de 40 000 t/an, destinée initialement à approvisionner en acide chlorhydrique, par canalisation, l’usine voisine Aliphos, filiale d’Ecophos de production de phosphate de calcium pour l’alimentation animale. L’énergie produite alimente en vapeur d’eau la distillerie de Ryssen Alcools proche. Après la faillite, en 2020, de l’usine d’Aliphos, l’acide produit est vendu.
HCl produit lors de l’incinération des ordures ménagères est éliminé à 95-99 % par lavage, à l’eau, des gaz de combustion. Il provient, pour environ moitié des émissions, de la présence de PVC.
Schéma de production Cl2 – HCl
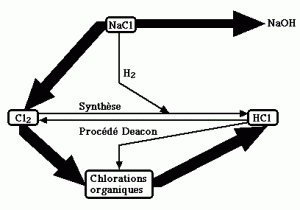
Conditionnement – Transport
Le chlorure d’hydrogène se présente :
- Sous forme liquide anhydre, surmonté par sa forme gazeuse, sous pression de 37,85 bar à 15°C, dans des bouteilles.
- Sous forme acide, en solution aqueuse de 33 % à 35 %. La solution concentrée, au contact de l’air atmosphérique, émet du chlorure d’hydrogène gazeux qui en présence de l’humidité atmosphérique donne de fines gouttelettes d’acide qui forment un brouillard.
Productions
Comptées en HCl à 100 %.
La capacité de production mondiale est estimée à 100 millions de t/an dont les 3/4 sont destinés à des usages captifs.
En 2010, la production des États-Unis est de 3,7 millions de t, celle du Japon est, en 2017, de 280 645 t produites par synthèse et 406 058 t coproduites.
La production de l’Union européenne est, en 2024, de 4,902 millions de t, dont 1,762 million de t en Allemagne, 1,036 million de t en France, en 2022, 727 439 t en Belgique, 315 918 t en Hongrie, 275 365 t au Portugal, 261 701 t en Italie, 229 000 t, en 2021, aux Pays Bas, 111 067 t, en 2020, en Espagne, 64 641 t en Roumanie, 56 977 t en Pologne, 40 336 t en Finlande, 29 368 t, en 2019, en Slovaquie.
Commerce international : en 2024.
Principaux pays exportateurs : sur un total de 2,298 millions de t.
| Allemagne | 469 | Hongrie | 132 | |
| Canada | 278 | États-Unis | 127 | |
| Belgique | 234 | Inde | 112 | |
| Pays Bas | 169 | Autriche | 64 | |
| Espagne | 151 | Pologne | 62 |
Source : ITC
Les exportations allemandes sont destinées aux Pays Bas à 33 %, à la France à 18 %, à la Belgique à 12 %, à la Suisse à 6 %.
Principaux pays importateurs.
| États-Unis | 317 | Pologne | 70 | |
| France | 289 | Italie | 67 | |
| Allemagne | 225 | Suède | 48 | |
| Belgique | 131 | Autriche | 43 | |
| Pays Bas | 124 | Suisse | 41 |
Source : ITC
Les importations des États-Unis proviennent à 86 % du Canada, 4 % du Japon, 4 % d’Allemagne.
Quelques producteurs importants :
- Olin, en octobre 2015, a acquis les activités de Dow Chemicals dans les solvants chlorés dans le monde et les produits chlorovinyliques aux États-Unis. Les unités de production sont situées aux États-Unis, à Mc Intosh, dans l’Alabama, Niagara Falls, dans l’État de New-York, Charleston, dans le Tennessee et à Freeport, au Texas ainsi qu’au Canada, à Becancour, au Québec.
- Dow Chemicals : aux États-Unis, à La Porte et Oyster Creek, au Texas, Midland, dans le Michigan, en Allemagne à Schkopau et Stade, au Brésil, à Aratu, au Portugal, à Estarreja.
- Formosa Plastics : avec des capacités de production de 126 700 t/an à Taipei chinois et, aux États-Unis, une production captive utilisée dans la production de chlorure de vinyle à Baton Rouge, en Louisiane et Point Confort, au Texas et une production commercialisée à Point Confort, au Texas.
- Westlake Chemical qui a acquis Axiall, en août 2016 : à Plaquemine, Geismar et Lake Charles, en Louisiane, à Calvert City, dans le Kentucky, aux États-Unis, le chlorure d’hydrogène produit est entièrement utilisé pour la production de chlorure de vinyle. Par ailleurs, Westlake produit du chlorure d’hydrogène aux États-Unis, à Natrium, en Virginie Occidentale, Longview, dans l’État de Washington, au Canada, à Beauharnois, dans la province de Québec, à Taipei chinois, à Kaohsiung avec 60 % de la société productrice.
- Oxy (Occidental Petroleum Corporation) : recycle le chlorure d’hydrogène pour produire du chlorure de vinyle, aux États-Unis, à Convent et Geimar, en Louisiane et commercialise de l’acide chlorhydrique à Wichita, au Kansas et à Niagara Falls, dans l’État de New-York. Produit également du chlorure d’hydrogène à Talcahuano, au Chili.
- Chemours : à Corpus Christi, au Texas, aux États-Unis et à Dordrecht, aux Pays Bas.
- BASF : à Geismar, en Louisiane, aux États-Unis, avec une capacité de production de 160 000 t/an comme co-produit de la fabrication de MDI et TDI, à Ludwigshafen et Schwarzheide, en Allemagne.
- Covestro : à Baytown, au Texas, aux États-Unis, Shanghai, en Chine, Dormagen, Brunsbüttel et Uerdingen, en Allemagne, Tarragone, en Espagne.
- Tosoh Corporation : le chlorure d’hydrogène produit est entièrement utilisé, au Japon, pour la production de chlorure de vinyle, qui représente 40 % de la production japonaise.
- Nouryon qui a repris les spécialités chimiques de Akzo Nobel : produit, par le biais de sa filiale Nobian, en particulier du chlorure d’hydrogène, par incinération de résidus chlorés dans son usine de Rotterdam, aux Pays Bas.
- Tessenderlo Group : le chlorure d’hydrogène est coproduit lors de la fabrication de sulfate de potassium à Ham, en Belgique. Le chlorure d’hydrogène ainsi produit est consommé en interne pour produire du chlorure de vinyle, de la gélatine et divers composés chlorés.
Recyclage
Le chlorure ferreux formé lors du décapage de l’acier par l’acide chlorhydrique peut être traité, par pyrohydrolyse, à 600-800°C, afin de redonner du chlorure d’hydrogène, selon la réaction suivante :
4 FeCl2 + 4 H2O + O2 = 8 HCl + 2 Fe2O3
Situation française
Production : 1 036 627 t, en 2022.
Commerce extérieur : en 2024.
Les exportations étaient de 39 354 t avec comme principaux marchés à :
- 55 % la Belgique,
- 16 % la Suisse,
- 7 % l’Italie,
- 4 % l’Allemagne.
Les importations s’élevaient à 288 607 t en provenance principalement à :
- 33 % de Belgique,
- 28 % d’Allemagne,
- 20 % d’Espagne,
- 3 % d’Italie.
Producteurs :
- Kem One, issu mi-2012, du pôle vinylique d’Arkema, coproduit et réutilise du chlorure d’hydrogène lors de la production de chlorure de vinyle monomère à Fos-sur-Mer (13) et Lavéra (13) ainsi que lors de la fabrication de chlorométhanes à Lavéra.
- Arkema à Jarrie (38) avec une production de chlorure de méthyle et à Saint-Auban (04), avec une production à partir de l’incinération de résidus de fabrication chlorés.
- Inovyn, filiale d’Ineos, à Tavaux (39) : production issue de la production de chlorure de vinyle et de chlorométhanes et destinée à la production de ces mêmes produits.
- Seqens, à Pont de Claix (38) : produit du chlorure d’hydrogène par synthèse.
Utilisations
Consommation : répartition, en 2022.
| Chine | 46 % | Autres pays asiatiques | 12 % | |
| États-Unis | 15 % | Japon | 4 % | |
| Europe de l’Ouest | 14 % | Moyen Orient | 3 % |
Source : S&P Global
Principaux secteurs d’utilisation du chlorure d’hydrogène
En 2018, dans le monde. Source : IHS Markit et Market Research Future
Secteurs d’utilisation : en 2018, dans le monde.
| PVC | 37 % | Décapage métaux | 13 % | |
| Agroalimentaire | 17 % | Exploitations minières | 9 % | |
| Exploitations pétrolières | 13 % | Chlorure de calcium | 8 % |
Source : IHS Markit et Market Research Future
Environ 110 procédés industriels utilisent du chlorure d’hydrogène comme matière première, dans :
L’industrie chimique :
- Synthèse du chlorure de vinyle monomère (conduisant au PVC), voir le chapitre consacré au PVC.
- Production de chlorures d’alkyle (méthyle, éthyle) à partir d’alcools.
- Production de chlorures métalliques (chlorures d’aluminium et de fer destinés à la floculation et la coagulation dans le traitement de l’eau), de silicium (trichlorosilane destiné à l’élaboration du silicium de qualité électronique).
- Production de chlorure de calcium : destiné au déneigement et à la déshydratation. Par exemple, le groupe Tessenderlo produit depuis 2016, à Ham, en Belgique, en association avec le groupe Tetra Chemicals, du chlorure de calcium à partir du chlorure d’hydrogène co-produit lors de la fabrication du sulfate de potassium (voir le chapitre chlorure de calcium).
- Préparation de colles, caoutchouc naturel (coagulation du latex et chloration du caoutchouc) et artificiel (chloroprène).
- Du dichlore est également produit en Europe de l’ouest (environ 3 % de la production), à partir de HCl, sous-produit de chlorations organiques, par électrolyse de sa solution aqueuse. En Europe, cette production, a exclusivement lieu en Allemagne par la société Covestro. Le procédé Uhde, utilisé depuis les années 70, emploie de l’acide à des concentrations comprises entre 15 et 22 % dans des cellules à diaphragme. Le procédé De Nora, basé sur la technologie ODC (Oxygen Depolarised Cathode), utilise une séparation par membrane. Cette technologie qui apporte du dioxygène à la cathode permet, en formant de l’eau, d’éviter de produire du dihydrogène et ainsi diminue la surtension nécessaire (économie de 30 % d’électricité). La capacité mondiale de dichlore ainsi produit, à partir de HCl, est de 2 millions de t/an de Cl2.
La régénération des résines échangeuses de cations, en particulier dans l’industrie alimentaire. Aux États-Unis et au Canada, cette utilisation représente 3/4 de l’utilisation de l’acide chlorhydrique dans l’agroalimentaire et les boissons. Les résines échangeuses d’ions sont employées dans la purification du sirop de maïs à haute teneur en fructose (HFCS) utilisé, à grande échelle dans ces pays, comme agent sucrant des sodas. L’amidon de maïs est transformé, en glucose et fructose, à l’aide de diverses enzymes. L’alpha-amylase le transforme en oligosaccharides, constitués de chaînes de sucres plus courtes, eux-mêmes décomposés par la glucoamylase en glucose, sucre le plus simple. Une dernière enzyme, la glucose-6-phosphate isomérase, convertit le glucose en un mélange d’environ 42 % de fructose et 50 à 52 % de glucose. Ce mélange, par chromatographie liquide, est concentré jusqu’à 90 % de fructose pour obtenir le HFCS 90. Les impuretés contenues sont éliminées par adsorption sur charbon actif, filtration et passage sur résines échangeuses d’ions.
La préparation de la gélatine : la gélatine est une protéine obtenue à partir de matières premières animales contenant du collagène. Dans le monde, en 2013, 40 % des matières premières utilisées sont des couennes de porcs, 30 % des os de porcs, bovins, volailles, poissons. Pour donner de la gélatine de type A, les couennes de porc sont plongées dans de l’acide chlorhydrique, à la température ambiante, pendant 24 h. Après de nombreux lavages à l’eau froide, destinés à éliminer l’acide, le collagène est hydrolysé en gélatine, soluble dans l’eau chaude. La gélatine est ainsi extraite en plusieurs fois en augmentant la température de l’eau. La solution est ensuite concentrée par évaporation sous vide, séchée et stérilisée à 140°C.
La production mondiale a été de 413 000 t, en 2015.
Le n°1 mondial est Rousselot, filiale du groupe Darling Ingredients, avec une capacité de production de 80 000 t/an soit 1/4 de la production mondiale dans 13 sites de production dans le monde, dont 2 en France, à l’Isles-sur-la-Sorgue (84) et Angoulême (16).
Le n°2 mondial est la société allemande, Gelita, avec 80 000 t/an.
PB Leiner, société du groupe Tessenderlo, avec 8 usines dans le monde dont une, en Belgique, à Vilvorde, possède des capacités de production de 50 000 t/an et est ainsi le 3ème producteur mondial de gélatine.
En 2018, l’alimentation et les boissons comptent pour 63 % des utilisations, les produits pharmaceutiques pour 31 %, les applications techniques (photographie…) pour 6 %.
L’industrie pétrolière et en particulier la récupération du pétrole et du gaz de schiste. L’acide chlorhydrique à une concentration d’environ 15 % est utilisé, dans la fracturation hydraulique, pour dissoudre les carbonates et augmenter la porosité de la roche. Cette utilisation est en plein développement aux États-Unis et au Canada.
Le décapage des métaux (les chlorures formés sont en général solubles) et en particulier de l’acier. Cette application consomme de l’acide à environ 18 %. La réaction dans le cas de l’acier est la suivante :
Fe2O3 + Fe + 6 HCl = 3 Fe2+ + 6 Cl– + 3 H2O
La concentration en chlorure ferreux de l’acide chlorhydrique augmente au cours des traitements jusqu’à atteindre 140 à 150 g/L de Fe. La solution de traitement peut être régénérée, voir la partie recyclage. Par exemple, la société Indaver approvisionne en acide chlorhydrique, avec 165 000 t/an, l’usine de Ijmuiden, aux Pays Bas, du groupe sidérurgique Tata Steel.
L’alimentation animale : des phosphates dicalciques sont préparés par neutralisation, à l’aide de chaux, de la solution d’attaque des os par l’acide chlorhydrique lors de la fabrication de la gélatine, par exemple à Vilvoorde, en Belgique par Tessenderlo. Ils sont également obtenus par attaque par HCl de phosphates naturels.
Bibliographie
Archives