Voir chlorure d’hydrogène
Chlorure d’hydrogène
Données physico-chimiques
Données atomiques
| Formule | Masse molaire | Distance interatomique | Moment dipolaire |
| HCl | 36,46 g.mol-1 | 127,4 pm | 1,1086 D |
Données physiques
| Masse volumique | Température de fusion | Température d’ébullition | Température critique | Pression critique | Température point triple | Pression point triple | Conductibilité thermique | Solubilité dans l’eau |
|
-88,5°C | -67,0°C | 51,35°C | 8 260 kPa | -114°C | 13,8 kPa | 13,16 W.m-1K-1 |
|
Données chimiques
| pKa : HCl/Cl– |
E° : Cl2(g) + 2e = 2Cl– |
pKs : AgCl |
pKs : CuCl | pKs : Hg2Cl | pKs : PbCl2 | pKs : TlCl |
| -7 | 1,358 V | 9,7 | 6,7 | 17,9 | 4,7 | 3,7 |
Données thermodynamiques
Chlorure d’hydrogène gazeux
|
|
Données industrielles
Le chlorure d’hydrogène est, dans les conditions normales, gazeux. Sa dissolution dans l’eau donne l’acide chlorhydrique. La concentration de l’acide est limitée par la solubilité du chlorure d’hydrogène dans l’eau soit, à 20°C, 720 g/L. En solution aqueuse, le chlorure d’hydrogène est totalement dissocié, l’acide chlorhydrique étant un acide fort, selon :
HCl(g) + H2O(l) = H3O+(aq) + Cl–(aq)
Du chlorure d’hydrogène est présent dans les éruptions volcaniques (de 0,5 à 11 millions de t de HCl/an). Par exemple, lors de son éruption de juin 1991, le Pinatubo, dans les Philippines, a émis de 0,5 à 5 millions de t de HCl dans l’atmosphère.
La production de HCl par l’organisme humain donne à l’estomac son pH acide, compris entre 1 et 2.
Fabrication industrielle
Le chlorure d’hydrogène peut être produit par synthèse directe entre le dichlore et le dihydrogène, cela représente environ 15 % de la production mondiale, mais l’origine principale du chlorure d’hydrogène est par coproduction lors de diverses réactions chimiques et lors de la combustion de composés chlorés. On considère que 40 procédés industriels génèrent comme co-produit du chlorure d’hydrogène.
Synthèse
Celle-ci à un coût de revient plus élevé que la coproduction mais elle donne du chlorure d’hydrogène plus pur, réservé à des utilisations dans l’élaboration de produits alimentaires et pharmaceutiques. La synthèse est réalisée par combustion du dichlore avec le dihydrogène, la température atteinte, 2500°C, nécessitant l’emploi de brûleurs en graphite.
H2(g) + Cl2(g) = 2 HCl(g)
La réaction a lieu en présence d’un excès de dihydrogène afin d’être sûr que tout le dichlore a réagi, car le mélange des deux gaz est explosif. L’électrolyse du chlorure de sodium en solution aqueuse donne du dichlore mais aussi du dihydrogène de grande pureté qui peut être utilisé pour la synthèse du chlorure d’hydrogène de qualité alimentaire. Ainsi, 95 % des unités de synthèse de HCl utilisent le dichlore et le dihydrogène produits par électrolyse du chlorure de sodium.
En 2012, aux États-Unis, la synthèse de HCl a représenté 6 % de la consommation de dichlore et, en 2016, la production de chlorure d’hydrogène est réalisée à 25 % par synthèse et 75 % par coproduction.
Coproduction lors de la formation de composés organiques chlorés
Chloration des composés aliphatiques par substitution et formation de solvants chlorés ou d’intermédiaires chimiques (voir le chapitre solvants chlorés) :
CH4 + n Cl2 = CH4-nCln + n HCl
Chloration des composés aromatiques (benzène, toluène) par substitution : en particulier lors de la production de monochlorobenzène pour la fabrication du phénol (voir ce chapitre) et de l’aniline.
Ar-H + Cl2 = Ar-Cl + HCl
Fabrication du chlorure de vinyle monomère destiné à la fabrication, par polymérisation, du PVC (voir le chapitre PVC) : la chloration de l’éthylène donne du 1,2-dichloroéthane qui par craquage se décompose en chlorure d’hydrogène et chlorure de vinyle :
C2H4 + Cl2 = C2H4Cl2
C2H4Cl2 = C2H3Cl + HCl
Toutefois, le chlorure d’hydrogène coproduit est recyclé pour produire à nouveau du 1,2-dichloroéthane, par oxychloration :
C2H4 + 2 HCl + 1/2 O2 = C2H4Cl2 + H2O
En conséquence, bien que du chlorure d’hydrogène soit coproduit, il est, en général, consommé par les unités productrices. Pour cette raison, les principaux producteurs de chlorure d’hydrogène sont les principaux producteurs de PVC.
Fabrication du diisocyanate de diphénylméthane (MDI) et du diisocyanate de toluène (TDI) destinés à la production de polyuréthane : le TDI est obtenu par réaction entre le diaminotoluène (ou 2-méthylbenzène-1,4-diamine) et le phosgène qui donne du diisocyanate de toluène et du chlorure d’hydrogène selon l’équation suivante :
CH3C6H3(NH2)2 + 2 COCl2 = CH3C6H3(NCO)2 + 4 HCl
Fabrication de silicones : la réaction du chlorure de méthyle (CH3Cl) avec le silicium, en présence de catalyseurs (dérivés de cuivre), donne, principalement, du diméthyldichlorosilane, (CH3)2SiCl2. L’hydrolyse de ce dernier donne du diméthylsilanediol, (CH3)2Si(OH)2 et du chlorure d’hydrogène.
(CH3)2SiCl2 + 2 H2O = (CH3)2Si(OH)2 + 2 HCl
Le chlorure d’hydrogène formé peut être récupéré pour donner avec du méthanol, à nouveau du chlorure de méthyle (voir le chapitre solvants chlorés), matière première de base pour la fabrication des silicones, selon la réaction suivante :
CH3OH + HCl = CH3Cl + H2O
Coproduction lors de la formation de composés minéraux
Sulfate de sodium : le sulfate de sodium peut être fabriqué par réaction, dans des fours Mannheim, à 500-600°C, entre l’acide sulfurique concentré et le chlorure de sodium selon la réaction :
2 NaCl + H2SO4 = Na2SO4 + 2 HCl
Le sulfate de sodium est extrait également de gisements naturels et co-produit lors de diverses fabrications chimiques.
Il est destiné à la fabrication de la pâte à papier, du verre, des lessives (voir le chapitre sulfate de sodium).
Sulfate de potassium : le sulfate de potassium peut être obtenu par action de l’acide sulfurique concentré sur du chlorure de potassium dans des fours Mannheim, à 800°C, selon la réaction :
2 KCl + H2SO4 = K2SO4 + 2 HCl
La production d’une tonne de sulfate de potassium entraîne la coproduction de 1,2 t de chlorure d’hydrogène.
Ce procédé est utilisé pour 50 à 60 % des capacités mondiales de production de sulfate de potassium. Par exemple, Tessenderlo Group, 3ème producteur mondial possède, à Ham, en Belgique, des capacités de production de 750 000 t/an de sulfate de potassium. Ce procédé, à prix de revient élevé, ne peut être intéressant que si le chlorure d’hydrogène co-produit, transformé en acide chlorhydrique, est valorisé.
D’autres procédés extraient le sulfate de potassium de mines de potasse ou de lac salés.
Il est destiné à la fertilisation de sols salés ou à la culture de plantes sensibles aux ions chlorures (voir le chapitre sulfate de potassium).
Incinération de résidus chlorés
La fabrication de dichloroéthane, chlorure de vinyle monomère, chlorométhanes et solvants chlorés, donne des résidus chlorés. L’incinération, à 1 200°C, de ces résidus, donne de l’acide chlorhydrique de qualité commerciale (à 33 %) qui est recyclé ou commercialisé. Par exemple, la capacité totale de traitement de l’atelier VRC (Valorisation de Résidus Chlorés) du site Arkema de Saint-Auban (04) est de 25 000 t/an.
L’incinération des PCB (polychlorobiphényls ou pyralène) donne également du HCl. Par exemple, le groupe Séché Environnement, à Saint-Vulbas (01) produit ainsi 3 500 t/an de HCl.
Depuis 2021, la société belge Indaver a construit, à Loon-Plage, près de Dunkerque, une usine de traitement de résidus chlorés, principalement issus de l’industrie du PVC, avec une capacité de 40 000 t/an, destinée initialement à approvisionner en acide chlorhydrique, par canalisation, l’usine voisine Aliphos, filiale d’Ecophos de production de phosphate de calcium pour l’alimentation animale. L’énergie produite alimente en vapeur d’eau la distillerie de Ryssen Alcools proche. Après la faillite, en 2020, de l’usine d’Aliphos, l’acide produit est vendu.
HCl produit lors de l’incinération des ordures ménagères est éliminé à 95-99 % par lavage, à l’eau, des gaz de combustion. Il provient, pour environ moitié des émissions, de la présence de PVC.
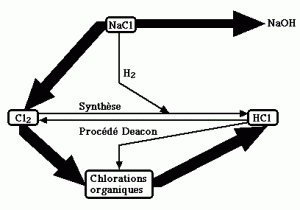
Schéma de production Cl2 – HCl
Conditionnement – Transport
Le chlorure d’hydrogène se présente :
- Sous forme liquide anhydre, surmonté par sa forme gazeuse, sous pression de 37,85 bar à 15°C, dans des bouteilles.
- Sous forme acide, en solution aqueuse de 33 % à 35 %. La solution concentrée, au contact de l’air atmosphérique, émet du chlorure d’hydrogène gazeux qui en présence de l’humidité atmosphérique donne de fines gouttelettes d’acide qui forment un brouillard.
Productions
Comptées en HCl à 100 %.
La capacité de production mondiale est estimée à 100 millions de t/an dont les 3/4 sont destinés à des usages captifs.
En 2010, la production des États-Unis est de 3,7 millions de t, celle du Japon est, en 2017, de 280 645 t produites par synthèse et 406 058 t coproduites.
La production de l’Union européenne est, en 2024, de 4,902 millions de t, dont 1,762 million de t en Allemagne, 1,036 million de t en France, en 2022, 727 439 t en Belgique, 315 918 t en Hongrie, 275 365 t au Portugal, 261 701 t en Italie, 229 000 t, en 2021, aux Pays Bas, 111 067 t, en 2020, en Espagne, 64 641 t en Roumanie, 56 977 t en Pologne, 40 336 t en Finlande, 29 368 t, en 2019, en Slovaquie.
Commerce international : en 2024.
Principaux pays exportateurs : sur un total de 2,298 millions de t.
| Allemagne | 469 | Hongrie | 132 | |
| Canada | 278 | États-Unis | 127 | |
| Belgique | 234 | Inde | 112 | |
| Pays Bas | 169 | Autriche | 64 | |
| Espagne | 151 | Pologne | 62 |
Source : ITC
Les exportations allemandes sont destinées aux Pays Bas à 33 %, à la France à 18 %, à la Belgique à 12 %, à la Suisse à 6 %.
Principaux pays importateurs.
| États-Unis | 317 | Pologne | 70 | |
| France | 289 | Italie | 67 | |
| Allemagne | 225 | Suède | 48 | |
| Belgique | 131 | Autriche | 43 | |
| Pays Bas | 124 | Suisse | 41 |
Source : ITC
Les importations des États-Unis proviennent à 86 % du Canada, 4 % du Japon, 4 % d’Allemagne.
Quelques producteurs importants :
- Olin, en octobre 2015, a acquis les activités de Dow Chemicals dans les solvants chlorés dans le monde et les produits chlorovinyliques aux États-Unis. Les unités de production sont situées aux États-Unis, à Mc Intosh, dans l’Alabama, Niagara Falls, dans l’État de New-York, Charleston, dans le Tennessee et à Freeport, au Texas ainsi qu’au Canada, à Becancour, au Québec.
- Dow Chemicals : aux États-Unis, à La Porte et Oyster Creek, au Texas, Midland, dans le Michigan, en Allemagne à Schkopau et Stade, au Brésil, à Aratu, au Portugal, à Estarreja.
- Formosa Plastics : avec des capacités de production de 126 700 t/an à Taipei chinois et, aux États-Unis, une production captive utilisée dans la production de chlorure de vinyle à Baton Rouge, en Louisiane et Point Confort, au Texas et une production commercialisée à Point Confort, au Texas.
- Westlake Chemical qui a acquis Axiall, en août 2016 : à Plaquemine, Geismar et Lake Charles, en Louisiane, à Calvert City, dans le Kentucky, aux États-Unis, le chlorure d’hydrogène produit est entièrement utilisé pour la production de chlorure de vinyle. Par ailleurs, Westlake produit du chlorure d’hydrogène aux États-Unis, à Natrium, en Virginie Occidentale, Longview, dans l’État de Washington, au Canada, à Beauharnois, dans la province de Québec, à Taipei chinois, à Kaohsiung avec 60 % de la société productrice.
- Oxy (Occidental Petroleum Corporation) : recycle le chlorure d’hydrogène pour produire du chlorure de vinyle, aux États-Unis, à Convent et Geimar, en Louisiane et commercialise de l’acide chlorhydrique à Wichita, au Kansas et à Niagara Falls, dans l’État de New-York. Produit également du chlorure d’hydrogène à Talcahuano, au Chili.
- Chemours : à Corpus Christi, au Texas, aux États-Unis et à Dordrecht, aux Pays Bas.
- BASF : à Geismar, en Louisiane, aux États-Unis, avec une capacité de production de 160 000 t/an comme co-produit de la fabrication de MDI et TDI, à Ludwigshafen et Schwarzheide, en Allemagne.
- Covestro : à Baytown, au Texas, aux États-Unis, Shanghai, en Chine, Dormagen, Brunsbüttel et Uerdingen, en Allemagne, Tarragone, en Espagne.
- Tosoh Corporation : le chlorure d’hydrogène produit est entièrement utilisé, au Japon, pour la production de chlorure de vinyle, qui représente 40 % de la production japonaise.
- Nouryon qui a repris les spécialités chimiques de Akzo Nobel : produit, par le biais de sa filiale Nobian, en particulier du chlorure d’hydrogène, par incinération de résidus chlorés dans son usine de Rotterdam, aux Pays Bas.
- Tessenderlo Group : le chlorure d’hydrogène est coproduit lors de la fabrication de sulfate de potassium à Ham, en Belgique. Le chlorure d’hydrogène ainsi produit est consommé en interne pour produire du chlorure de vinyle, de la gélatine et divers composés chlorés.
Recyclage
Le chlorure ferreux formé lors du décapage de l’acier par l’acide chlorhydrique peut être traité, par pyrohydrolyse, à 600-800°C, afin de redonner du chlorure d’hydrogène, selon la réaction suivante :
4 FeCl2 + 4 H2O + O2 = 8 HCl + 2 Fe2O3
Situation française
Production : 1 036 627 t, en 2022.
Commerce extérieur : en 2024.
Les exportations étaient de 39 354 t avec comme principaux marchés à :
- 55 % la Belgique,
- 16 % la Suisse,
- 7 % l’Italie,
- 4 % l’Allemagne.
Les importations s’élevaient à 288 607 t en provenance principalement à :
- 33 % de Belgique,
- 28 % d’Allemagne,
- 20 % d’Espagne,
- 3 % d’Italie.
Producteurs :
- Kem One, issu mi-2012, du pôle vinylique d’Arkema, coproduit et réutilise du chlorure d’hydrogène lors de la production de chlorure de vinyle monomère à Fos-sur-Mer (13) et Lavéra (13) ainsi que lors de la fabrication de chlorométhanes à Lavéra.
- Arkema à Jarrie (38) avec une production de chlorure de méthyle et à Saint-Auban (04), avec une production à partir de l’incinération de résidus de fabrication chlorés.
- Inovyn, filiale d’Ineos, à Tavaux (39) : production issue de la production de chlorure de vinyle et de chlorométhanes et destinée à la production de ces mêmes produits.
- Seqens, à Pont de Claix (38) : produit du chlorure d’hydrogène par synthèse.
Utilisations
Consommation : répartition, en 2022.
| Chine | 46 % | Autres pays asiatiques | 12 % | |
| États-Unis | 15 % | Japon | 4 % | |
| Europe de l’Ouest | 14 % | Moyen Orient | 3 % |
Source : S&P Global
Principaux secteurs d’utilisation du chlorure d’hydrogène
En 2018, dans le monde. Source : IHS Markit et Market Research Future
Secteurs d’utilisation : en 2018, dans le monde.
| PVC | 37 % | Décapage métaux | 13 % | |
| Agroalimentaire | 17 % | Exploitations minières | 9 % | |
| Exploitations pétrolières | 13 % | Chlorure de calcium | 8 % |
Source : IHS Markit et Market Research Future
Environ 110 procédés industriels utilisent du chlorure d’hydrogène comme matière première, dans :
L’industrie chimique :
- Synthèse du chlorure de vinyle monomère (conduisant au PVC), voir le chapitre consacré au PVC.
- Production de chlorures d’alkyle (méthyle, éthyle) à partir d’alcools.
- Production de chlorures métalliques (chlorures d’aluminium et de fer destinés à la floculation et la coagulation dans le traitement de l’eau), de silicium (trichlorosilane destiné à l’élaboration du silicium de qualité électronique).
- Production de chlorure de calcium : destiné au déneigement et à la déshydratation. Par exemple, le groupe Tessenderlo produit depuis 2016, à Ham, en Belgique, en association avec le groupe Tetra Chemicals, du chlorure de calcium à partir du chlorure d’hydrogène co-produit lors de la fabrication du sulfate de potassium (voir le chapitre chlorure de calcium).
- Préparation de colles, caoutchouc naturel (coagulation du latex et chloration du caoutchouc) et artificiel (chloroprène).
- Du dichlore est également produit en Europe de l’ouest (environ 3 % de la production), à partir de HCl, sous-produit de chlorations organiques, par électrolyse de sa solution aqueuse. En Europe, cette production, a exclusivement lieu en Allemagne par la société Covestro. Le procédé Uhde, utilisé depuis les années 70, emploie de l’acide à des concentrations comprises entre 15 et 22 % dans des cellules à diaphragme. Le procédé De Nora, basé sur la technologie ODC (Oxygen Depolarised Cathode), utilise une séparation par membrane. Cette technologie qui apporte du dioxygène à la cathode permet, en formant de l’eau, d’éviter de produire du dihydrogène et ainsi diminue la surtension nécessaire (économie de 30 % d’électricité). La capacité mondiale de dichlore ainsi produit, à partir de HCl, est de 2 millions de t/an de Cl2.
La régénération des résines échangeuses de cations, en particulier dans l’industrie alimentaire. Aux États-Unis et au Canada, cette utilisation représente 3/4 de l’utilisation de l’acide chlorhydrique dans l’agroalimentaire et les boissons. Les résines échangeuses d’ions sont employées dans la purification du sirop de maïs à haute teneur en fructose (HFCS) utilisé, à grande échelle dans ces pays, comme agent sucrant des sodas. L’amidon de maïs est transformé, en glucose et fructose, à l’aide de diverses enzymes. L’alpha-amylase le transforme en oligosaccharides, constitués de chaînes de sucres plus courtes, eux-mêmes décomposés par la glucoamylase en glucose, sucre le plus simple. Une dernière enzyme, la glucose-6-phosphate isomérase, convertit le glucose en un mélange d’environ 42 % de fructose et 50 à 52 % de glucose. Ce mélange, par chromatographie liquide, est concentré jusqu’à 90 % de fructose pour obtenir le HFCS 90. Les impuretés contenues sont éliminées par adsorption sur charbon actif, filtration et passage sur résines échangeuses d’ions.
La préparation de la gélatine : la gélatine est une protéine obtenue à partir de matières premières animales contenant du collagène. Dans le monde, en 2013, 40 % des matières premières utilisées sont des couennes de porcs, 30 % des os de porcs, bovins, volailles, poissons. Pour donner de la gélatine de type A, les couennes de porc sont plongées dans de l’acide chlorhydrique, à la température ambiante, pendant 24 h. Après de nombreux lavages à l’eau froide, destinés à éliminer l’acide, le collagène est hydrolysé en gélatine, soluble dans l’eau chaude. La gélatine est ainsi extraite en plusieurs fois en augmentant la température de l’eau. La solution est ensuite concentrée par évaporation sous vide, séchée et stérilisée à 140°C.
La production mondiale a été de 413 000 t, en 2015.
Le n°1 mondial est Rousselot, filiale du groupe Darling Ingredients, avec une capacité de production de 80 000 t/an soit 1/4 de la production mondiale dans 13 sites de production dans le monde, dont 2 en France, à l’Isles-sur-la-Sorgue (84) et Angoulême (16).
Le n°2 mondial est la société allemande, Gelita, avec 80 000 t/an.
PB Leiner, société du groupe Tessenderlo, avec 8 usines dans le monde dont une, en Belgique, à Vilvorde, possède des capacités de production de 50 000 t/an et est ainsi le 3ème producteur mondial de gélatine.
En 2018, l’alimentation et les boissons comptent pour 63 % des utilisations, les produits pharmaceutiques pour 31 %, les applications techniques (photographie…) pour 6 %.
L’industrie pétrolière et en particulier la récupération du pétrole et du gaz de schiste. L’acide chlorhydrique à une concentration d’environ 15 % est utilisé, dans la fracturation hydraulique, pour dissoudre les carbonates et augmenter la porosité de la roche. Cette utilisation est en plein développement aux États-Unis et au Canada.
Le décapage des métaux (les chlorures formés sont en général solubles) et en particulier de l’acier. Cette application consomme de l’acide à environ 18 %. La réaction dans le cas de l’acier est la suivante :
Fe2O3 + Fe + 6 HCl = 3 Fe2+ + 6 Cl– + 3 H2O
La concentration en chlorure ferreux de l’acide chlorhydrique augmente au cours des traitements jusqu’à atteindre 140 à 150 g/L de Fe. La solution de traitement peut être régénérée, voir la partie recyclage. Par exemple, la société Indaver approvisionne en acide chlorhydrique, avec 165 000 t/an, l’usine de Ijmuiden, aux Pays Bas, du groupe sidérurgique Tata Steel.
L’alimentation animale : des phosphates dicalciques sont préparés par neutralisation, à l’aide de chaux, de la solution d’attaque des os par l’acide chlorhydrique lors de la fabrication de la gélatine, par exemple à Vilvoorde, en Belgique par Tessenderlo. Ils sont également obtenus par attaque par HCl de phosphates naturels.
Bibliographie
Archives
Dichlore
Données physico-chimiques
Données atomiques
| Formule | Masse molaire | Distance interatomique |
| Cl2 | 70,906 g.mol-1 | 198,8 pm |
Données physiques
| Masse volumique | Température de fusion | Température d’ébullition | Température critique | Pression critique | Conductibilité thermique | Solubilité dans l’eau |
|
-100,98°C | -34,6°C | 144°C | 7 700 kPa | 0,0079 W.m-1K-1 |
|
Données chimiques
| E° : ClO3– + 6H+ + 5e = 1/2Cl2(g) + 3H2O | E° : Cl2(g) + 2e = 2Cl– | E° : 2HClO + 2H+ + 2e = Cl2(g) + 2H2O | E° : 2ClO– + 2H2O + 2e = Cl2(g) + 4OH– |
| 1,47 V | 1,358 V | 1,63 V | 0,40 V |
Données thermodynamiques
Dichlore gazeux :
|
Dichlore en solution aqueuse :
|
Données industrielles
Le dichlore est un produit synthétique préparé par l’industrie chimique principalement par oxydation électrochimique d’ions chlorure.
L’élément chlore est présent dans l’eau de mer sous forme d’ion chlorure avec, en moyenne, 19 g.L-1 soit 26.1015 t de Cl– et dans la croûte terrestre (avec une teneur moyenne de 0,03 %) sous forme de sels (NaCl, KCl…).
Il est également présent dans l’atmosphère sous forme de chlorure d’hydrogène (production mondiale de 0,5 à 11 millions de t/an par les éruptions volcaniques) et de chlorure de méthyle (5 millions de t/an provenant d’algues marines…).
Le corps humain contient 0,15 % de sa masse en ions chlorure (le sang à une teneur de 4,5 à 6 g.L-1, la concentration des sucs gastriques est de 0,03 mol.L-1 d’acide chlorhydrique).
Matières premières
Principalement le chlorure de sodium, NaCl, solide (naturel ou recristallisé) ou en solution aqueuse afin d’obtenir des saumures contenant environ 320 g.L-1 de NaCl. La consommation de NaCl est de 1,7 t/t de Cl2. Le chlorure de potassium est également utilisé, en moindre quantité, lorsque l’on désire obtenir comme coproduit de l’hydroxyde de potassium.
Fabrication industrielle
Principalement par électrolyse.
A partir généralement de NaCl en solution, mais aussi à partir de KCl en solution et NaCl fondu, en France, à Pomblière Saint Marcel (73), coproduit de la fabrication du sodium, voir le chapitre consacré au sodium.
Du dichlore est produit, selon le procédé Deacon, à partir de HCl gazeux, lors de la fabrication de chlorure de vinyle (voir le chapitre PVC) mais il est immédiatement consommé. Par ailleurs, Covestro, en Chine à Shanghai produit, selon le procédé Deacon, du dichlore, avec une capacité de production de 320 000 t/an, à partir du chlorure d’hydrogène coproduit lors de la fabrication d’isocyanates et ainsi le recycle.
Du dichlore est également produit en Europe de l’ouest (environ 3 % de la production), à partir de HCl, sous-produit de chlorations organiques, par électrolyse de solutions aqueuses (capacité mondiale : 2 millions de t/an de Cl2). En Europe, cette production, a exclusivement lieu en Allemagne par la société Covestro. Le procédé Uhde, utilisé depuis les années 70, emploie de l’acide à des concentrations comprises entre 15 et 22 % dans des cellules à diaphragme. Le procédé De Nora, basé sur la technologie ODC (Oxygen Depolarised Cathode), utilise une séparation par membrane. Cette technologie qui apporte du dioxygène à la cathode permet, en formant de l’eau, d’éviter de produire du dihydrogène et ainsi diminue la surtension nécessaire (économie de 30 % d’électricité).
L’électrolyse a lieu dans des cellules de 3 types : en % des capacités de production.
| Capacités de production | Monde, en 2019 | Union européenne, en 2025 | France, en 2025 |
| Membrane | 80 % | 81,6 % | 95,9 % |
| Diaphragme | 15 % | 10,5 % | 0 % |
| Mercure | 4 % | 0 % | 0 % |
| Divers | 1 % | 7,8 % | 4,1 % |
Sources : Euro Chlor et IHS
La plus importante usine de production, dans le monde, est celle exploitée par Olin, à Freeport, au Texas, aux États-Unis. Sa capacité de production est de 3,030 millions de t/an, 1,580 million de t/an par électrolyse à diaphragme et 1,450 million de t/an par électrolyse à membrane.
La plus importante unité de production en Europe est installée chez Dow Chemical à Stade, en Allemagne, avec une capacité de 1,027 million de t/an de Cl2 par électrolyse à diaphragme associée à une capacité de 602 000 t/an de Cl2 par électrolyse à membrane.
Il n’y a plus de projet, dans le monde, de construction d’usine à cathode de mercure. En 2018, l’abandon total de leur exploitation a eu lieu, en Europe.
En général, les nouvelles unités de production fonctionnent à l’aide de cellules à membranes.
Caractéristiques des différents procédés
| Procédé | Densité de courant (kA/m2) | Tension (V) | Consommation totale d’énergie (kWh/t Cl2) | ||
| Électrolyse | Concentration | Force motrice | |||
| Membrane | 5 – 7 | 3 – 3,6 | 2 500 à 5 kA/m2 | 180 | 140 |
| Diaphragme | 0,9 – 2,6 | 2,9 – 3,5 | 2 720 à 1,7 kA/m2 | 610 | 250 |
| Mercure | 8 – 13 | 3,9 – 4,2 | 3 360 à 10 kA/m2 | 0 | 200 |
Consommation d’énergie électrique : de 2 310 à 3 460 kWh/t de dichlore en 2022, en Europe, pour des cellules à membranes. En 2022, en Europe, la consommation d’énergie électrique représente de 58 à 62 % des coûts de production de Cl2.
Cellules à membrane
Schéma de fonctionnement (sur le site Euro Chlor)
Elles utilisent généralement du sel cristallisé mis en solution. La saumure doit être fortement purifiée (à l’aide de résines échangeuses d’ions). La concentration en Mg2+ et Ca2+ doit être inférieure à 20 ppb. La cellule est alimentée en saumure côté anode et en eau côté cathode.
Le séparateur des compartiments anodique et cathodique est constitué de membranes cationiques (perméable aux cations Na+) de 0,1 à 0,2 mm d’épaisseur. Ce sont des polymères perfluorosulfoniques (« Nafion » de Du Pont de Nemours) ou perfluorocarboxyliques (« Flemion » de Asahi Glass). Les cathodes sont en nickel, les anodes du type DSA. Les anodes DSA (Dimensionally Stables Anodes) sont de fines grilles en titane recouvertes d’oxydes de titane et ruthénium, la durée de vie de ce dépôt est de 5 à 8 ans.
La conductivité des membranes est faible et leur sélectivité est limitée par la concentration en NaOH. Actuellement la concentration maximale atteinte est de 30 à 35 % en NaOH, la soude ayant une teneur en NaCl inférieure à 50 ppm.
Cellules à diaphragme
Schéma de fonctionnement (sur le site Euro Chlor)
Elles utilisent directement du sel de dissolution qui est purifié pour éliminer les ions Ca2+ et Mg2+ susceptibles de former, lors de l’électrolyse, des hydroxydes qui colmateraient le diaphragme. Avant électrolyse, la saumure est traitée à l’aide d’hydroxyde de sodium et de carbonate de sodium pour éliminer, par précipitation, les ions Mg2+ sous forme d’hydroxyde et les ions Ca2+ sous forme de carbonate. Les ions métalliques présents (fer, titane, nickel, chrome, vanadium et molybdène) précipitent également sous forme d’hydroxydes. Dans certains cas, un traitement au carbonate ou au chlorure de baryum est mis en œuvre pour éliminer les ions sulfates. Les saumures destinées aux cellules à diaphragme doivent avoir les teneurs suivantes : Ca2+ < 2 mg/L, Mg2+ < 1 mg/L, ions sulfate < 5 g/L.
Le diaphragme est composé de fibres ; celles-ci étaient initialement en amiante, mais ont été remplacées par du PTFE (polytétrafluoréthylène) dans de nombreuses installations, particulièrement en France où cela est obligatoire depuis 2002. Il est changé après quelques années de fonctionnement. Les cathodes sont en grillage d’acier doux recouvert de nickel. Leur durée de vie est de 15 à 20 ans. Après électrolyse, la solution de soude (140 g/L de NaOH) contient également du NaCl (160 g/L) provenant de la saumure partiellement épuisée. La solution doit être concentrée par évaporation de l’eau (ce qui est coûteux en investissement et en énergie) au cours de laquelle NaCl cristallise, ce qui permet de le séparer de la solution et de le recycler. On obtient ainsi, une solution de NaOH à 50 % contenant de 1 à 2 g/L de NaCl. Le chlorure de sodium cristallisé récupéré peut être utilisé pour alimenter des cellules à membrane. Souvent, sur un même site de production, les procédés diaphragme et membrane sont utilisés en synergie de production/consommation de sel. L’électrolyse à diaphragme s’est surtout développée aux États-Unis.
Cellules à cathode de mercure
Elles utilisent, généralement, du sel cristallisé mis en solution saturée avec une concentration d’environ 320 g.L-1 de NaCl. Avant électrolyse, la saumure est purifiée afin d’atteindre les teneurs suivantes : Ca2+ < 2 mg/L, Mg2+ < 1 mg/L, ions sulfate < 5 g/L, comme dans le cas des cellules à diaphragme.
Chaque cellule de 10 à 30 m2 de surface sur 30 cm de hauteur peut contenir jusqu’à 250 plaques DSA (de 30×70 cm). Elles sont disposées parallèlement à la surface du mercure. Le mercure (3 à 4 t/cellule) jouant le rôle de cathode a une épaisseur de 3 mm et s’écoule à la vitesse de 1 m/s, la cuve étant inclinée. La distance entre les anodes et le mercure est de l’ordre de 5 mm. L’électrolyse est effectuée à une température de 85°C et le pH de la saumure se stabilise à environ 3,5. Il se forme un amalgame avec le mercure qui contient de 0,2 à 0,5 % de sodium.
Après électrolyse, la concentration de la saumure est d’environ 260 g.L-1 de NaCl. Elle est à nouveau concentrée par ajout de NaCl solide, l’électrolyse à cathode de mercure ne consommant pas d’eau dans la partie électrolyse. L’amalgame est décomposé, en présence d’eau déminéralisée, dans des tours ou des bacs d’acier remplis de morceaux de graphite imprégnés par un métal de transition (Fe, Ni ou Mo). Ce procédé donne, en général, de la soude exempte de NaCl, à une concentration de 50 %. Le dihydrogène formé est récupéré.
L’électrolyse à cathode de mercure est la technique industrielle la plus ancienne (elle date de 1888). Elle s’est surtout développée en Europe. Les capacités de production des usines sont de 50 000 à 300 000 t/an de dichlore. Une production de 250 000 t/an de Cl2 nécessite l’utilisation d’une centaine de cellules. Depuis 2018, la totalité des cellules à cathode de mercure a été, en Europe, remplacée par des cellules à membranes ou les usines ont été fermées.
Coproduits
NaOH : 1,13 t/t Cl2.
H2 : 28 kg/t Cl2. Ce dihydrogène est de haute pureté. Avec 240 000 t, il est, en 2024, en Europe, à 86,8 % valorisé pour produire divers produits tels que le méthanol, le peroxyde d’hydrogène, l’acide chlorhydrique… ou utilisé comme combustible.
Pour caractériser les productions résultant de l’électrolyse des solutions aqueuses de chlorure de sodium on utilise l’ECU (Electro-Chemical Unit) qui correspond à 1,0 t de dichlore, 1,1 t d’hydroxyde de sodium et 0,03 t de dihydrogène.
Remarques :
- L’électrolyse de NaCl produit simultanément Cl2 et NaOH. La production est, en général, commandée par la demande en Cl2. NaOH est facile à stocker, exporter ou importer et peut être produit par d’autres voies (voir le chapitre hydroxyde de sodium).
- Par mesure de sécurité, chaque unité d’électrolyse est équipée d’une installation capable d’absorber, en cas de nécessité, le chlore gazeux en le transformant en hypochlorite de sodium. Cette installation permet de recueillir, dans un réseau de canalisations en légère dépression, les dégazages divers contenant ou pouvant contenir du dichlore puis de fixer ce dichlore dans des solutions de soude caustique diluée ruisselant au sein d’une ou plusieurs tours en série.
Problèmes
Cellules à diaphragmes : principalement liés aux risques, pour la santé humaine, lors de la manipulation de l’amiante, pendant son extraction et ses transformations. Des diaphragmes sans amiante sont de plus en plus utilisés, particulièrement en Europe, où une seule usine utilise des diaphragmes en amiante, celle de Dow, à Stade, en Allemagne. Par contre, aux États-Unis, de nombreuses cellules à diaphragme utilisent de l’amiante.
Cellules à mercure : elles entraînent une pollution par le mercure. Par exemple, en 2020, la quantité de mercure présente dans les produits (dichlore, NaOH et dihydrogène) fournis par les 11 usines d’Amérique du Nord et du Sud et de Russie, était de 211 kg/an, dans l’eau de 73 kg/an et dans l’atmosphère de 2 384 kg/an.
En Europe, en moyenne, les émissions totales de mercure (produits, eau et air) étaient, en 2017, de 0,68 g de Hg/t de Cl2, soit 1,4 t de mercure, elles étaient de 2,60 g de Hg/t de Cl2, en 1995. Il faut cependant noter que les émissions de l’industrie du chlore représentaient moins de 1 % des émissions globales de mercure dans l’air.
Il n’y a plus de projet, dans le monde, de construction d’usine à cathode de mercure. L’abandon quasi total de leur exploitation a eu lieu, en Europe, fin 2017. Fin 2016, la quantité de mercure stocké dans ces installations d’électrolyse était, dans l’Union européenne, de 5 344 t dans 33 unités qui ont été en grande partie démantelées avant fin 2017. En 2017, dans le monde, 30 usines, avec 2,64 millions de t/an de capacité de production de dichlore, fonctionnaient avec des cellules à cathodes de mercure et émettaient 4,5 t de Hg/an. Ce mercure stocké dans les sites de production de dichlore est sous forme liquide et est donc susceptible d’émettre de la vapeur de mercure particulièrement toxique. Divers projets sont en cours de développement pour transformer ce mercure liquide en forme solide, non émettrice de vapeur, en général en sulfure, le cinabre. Par exemple, la société Batrec, du groupe Véolia, à Wimmis, en Suisse, possède une capacité de traitement de 1 200 t/an, avec l’ajout de soufre dans le mercure liquide, dans 3 réacteurs et après réaction récupère le cinabre dans un filtre-presse, puis le stocke dans les mines souterraines de potasse allemandes de Herfa-Neurode, en Hesse, du groupe K+S. D’autres sociétés, Econ Industries, avec une unité mobile de traitement, Mayasa Spain, à Almadén, en Espagne et Remondis, à Dorsten, en Allemagne, interviennent dans cette activité.
En 2021, en Europe, 251 t de mercure ont été éliminées, il en reste, fin 2022, 79 t présentes encore dans les unités qui utilisaient des cellules à cathode de mercure.
Principales unités de production dans le monde
| Lieu | Société | Capacité totale, en milliers de t/an |
Capacité par types de cellules | ||
| Membrane | Diaphragme sans amiante | Diaphragme avec amiante | |||
| Freeport, Texas | Olin | 3 030 | 1 450 | 1 580 | |
| Stade, Allemagne | Dow | 1 629 | 602 | 1 027 | |
| Lake Charles, Louisiane | Westlake | 1 270 | 1 020 | 250 | |
| Mailiao, Taipei chinois | Formosa Plastics | 1 209 | 1209 | ||
| Plaquemine, Louisiane | Shin Etsu | 1 055 | 1 055 | ||
| Shin-Nanyo, Japon | Tosoh | 1 022 | 1 022 | ||
| Urumqi, Xinjiang | Xinjiang Zhongtai | 1 000 | 1 000 | ||
| Plaquemine, Louisiane | Olin | 971 | 971 | ||
| Point Comfort, Texas | Formosa Plastics | 910 | 910 | ||
| Shihezi, Xinjiang | Tianye Group | 910 | 910 | ||
Source : « Chlorine and building materials« , HBN
Conditionnement et transport
A la sortie des cellules d’électrolyse, Cl2 à 90°C est saturé en vapeur d’eau. Il est refroidi, ce qui entraîne la condensation de la majeure partie de la vapeur d’eau, au-dessus de 12°C, afin d’éviter la formation d’hydrate de chlore puis séché, avec une teneur résiduelle d’eau de moins de 20 ppm, avec de l’acide sulfurique concentré dans des tours à garnissage. Il est nécessaire de sécher le dichlore le plus tôt possible afin de pouvoir manipuler le gaz dans des installations en acier courant. En effet, en présence de dichlore sec, il se forme à la surface de l’acier une couche passive de chlorure de fer qui est très soluble dans l’eau.
Les réservoirs de stockage fixes (ainsi que les postes de chargement/déchargement) sont souvent équipés d’un réseau d’eau sous pression pouvant former, en cas de fuite de dichlore, un « rideau » d’eau autour de l’installation.
Le dichlore est comprimé et liquéfié pour le transport.
En 2024, 96,1 % de la production européenne est transformée et consommée sur place ou est transportée par pipeline local vers des utilisateurs voisins et 3,9 % transportée, à 80 % par chemin de fer. En Europe, seulement le Royaume Uni utilise la voie routière et avec des limites l’Espagne et le Portugal.
Recyclage
Le dichlore sert à produire de très nombreux composés qui en fin de vie, en particulier après incinération, donnent du chlorure d’hydrogène qui est récupéré, en solution aqueuse sous forme d’acide chlorhydrique. HCl gazeux peut, par le procédé Deacon ou par électrolyse de sa solution, redonner du dichlore (voir le début du chapitre fabrication industrielle).
Productions
Production mondiale, en 2017 : 70 millions de t. Le dichlore est fabriqué sur 488 sites de production, disséminés dans 85 pays.
Capacités de productions : monde, en 2021 : 90,35 millions de t/an, Union européenne, en 2025 : 10,851 millions de t/an.
| Chine (2016) | 34 300 | Japon (2012) | 3 800 | |
| États-Unis (2019) | 10 938 | Russie (2012) | 1 500 | |
| Allemagne (2025) | 5 365 | Corée du Sud (2012) | 1 500 | |
| Inde (2020) | 4 131 | France (2025) | 1 013 |
Source : Euro Chlor
En 2019, la production des États-Unis a été de 10,94 millions de t, celle du Japon, en 2017, de 3,543 millions de t, celle de l’Inde, en 2018-19, de 3,136 millions de t.
Commerce international : en 2024. Celui-ci est très limité du fait les risques liés au transport du dichlore. La production est très majoritairement utilisée sur les lieux de production ou des lieux proches.
Principaux pays exportateurs sur un total de 493 344 t.
| Canada | 168 691 | Slovaquie | 18 261 | |
| Mexique | 98 290 | Colombie | 16 067 | |
| France | 32 142 | Allemagne | 13 979 | |
| Thaïlande | 20 703 | États-Unis | 9 624 | |
| Belgique | 20 347 | Roumanie | 9 477 |
Source : ITC
Les exportations du Canada sont destinées quasi totalement aux États-Unis.
Principaux pays importateurs, sur un total de 550 570 t.
| États-Unis | 267 846 | Allemagne | 11 512 | |
| Belgique | 43 188 | Suisse | 10 316 | |
| Hongrie | 32 750 | Malaisie | 10 254 | |
| Philippines | 22 769 | Ukraine | 9 348 | |
| Pays Bas | 11 689 | Arabie Saoudite | 8 447 |
Source : ITC
Les importations des États-Unis proviennent à 63 % du Canada, 35 % du Mexique.
Principaux producteurs : capacités annuelles de production, en 2021.
| Olin (États-Unis) | 5 375 | Formosa Plastics Group (Taipei chinois) | 2 363 | |
| Westlake (États-Unis) | 3 279 | Covestro (Allemagne) | 2 063 | |
| Oxy (États-Unis) | 2 900 | Inovyn (Royaume Uni), en 2025 | 1 852 | |
| Dow Chemical (États-Unis) | 2 376 | Nobian (Pays Bas), en 2025 | 1 222 |
Sources : Olin et rapports des sociétés
- Olin, en octobre 2015, a acquis les activités de Dow Chemical dans les solvants chlorés dans le monde et les produits chlorovinyliques aux États-Unis. Les unités de production sont situées aux États-Unis, à Freeport, au Texas, avec 3,069 millions de t/an, Plaquemine, en Louisiane, avec 845 000 t/an, Saint Gabriel, en Louisiane, avec 246 000 t/an, Mc Intosh, dans l’Alabama, avec 578 000 t/an, Niagara Falls, dans l’État de New-York, avec 240 000 t/an, Charleston, dans le Tennessee, avec 218 000 t/an et au Canada, à Becancour, au Québec, avec 175 000 t/an. Après avoir réduit, en 2021, ses capacités de production avec diaphragme de 200 000 t/an à Mc Intosh et de 225 000 t/an à Plaquemine, Olin poursuit, pour fin 2022, une diminution de 225 000 t/an de production avec diaphragme, à Freeport, au Texas ainsi que 200 000 t/an de production avec diaphragme à Mc InTosh, dans l’Alabama.
- Westlake a acquis Axiall qui avait regroupé, en janvier 2013, les activités dans le dichlore de Georgia Gulf et PPG. Les unités de production de dichlore sont situées aux États-Unis au Kentucky, à Calvert City, avec 250 000 t/an, en Louisiane à Lake Charles, avec 1,27 million de t/an, à Plaquemine, avec 426 000 t/an et Geismar, avec 317 000 t/an, en Virginie Occidentale à Natrium, avec 227 000 t/an, dans l’État de Washington à Longview, au Canada, à Beauharnois, au Québec, avec 88 000 t/an et à Taipei chinois, à Kaohsiung, avec 60 % d’une joint venture. En Allemagne, produit du dichlore via sa filiale, Vinnolit, à Gendorf avec 205 000 t/an et Knapsack avec 250 000 t/an.
- OxyChem exploite des unités de production aux États-Unis dans le Kansas à Wichita, avec 248 000 t/an, en Louisiane à Convent, avec 353 000 t/an, Taft, avec 650 000 t/an et Geismar, avec 438 000 t/an, au Texas à Dee Park, avec 295 000 t/an, La Porte, avec 525 000 t/an et Ingleside, avec 570 000 t/an, dans l’État de New-York à Niagara Falls, avec 335 000 t/an, au Tennessee à New Johnsonville, avec 165 000 t/an. produit également du dichlore au Chili, à Talcahuano.
- Dow Chemical produit du dichlore dans l’Union européenne (voir ci-dessous) et au Brésil, à Aratu, dans l’État de Bahia.
- Formosa Plastics, possède des capacités de production de 717 273 t/an aux États-Unis à Point Comfort, au Texas et Baton Rouge, en Louisiane et de 366 700 t/an à Taipei chinois.
- Covestro produit du dichlore en Allemagne (voir ci-dessous), aux États-Unis, à Baytown, au Texas avec 363 000 t/an et en Chine à Shanghai, selon le procédé Deacon avec 320 000 t/an.
- Inovyn, société du groupe Ineos, produit du dichlore dans l’Union européenne (voir ci-dessous) et en Norvège, à Rafnes avec 315 000 t/an.
- Nobian est issue, en 2021, du groupe Nouryon.
Capacités de production dans l’Union européenne, au 1er janvier 2025 : 10,851 millions de t/an, dans 60 usines.
| Allemagne | 5 365 | Espagne | 524 | |
| Belgique | 1 074 | Hongrie | 480 | |
| France | 1 013 | Pologne | 405 | |
| Pays Bas | 847 | Italie | 358 |
Source : Euro Chlor
Production de l’Union européenne, en 2024, en milliers de t : total : 5 768, dont Allemagne : 2 470, France : 791, Hongrie : 373, en 2023, Espagne : 302, Roumanie : 154, Italie : 154, Portugal : 119. Les productions de Belgique et des Pays Bas sont confidentielles.
Principaux producteurs européens, principaux sites et capacités de production : au 1er janvier 2025 et ( ) type de cellules utilisées. M : membranes, D : diaphragme, HCl : électrolyse de HCl.
| Dow Chemical (1 882) |
Stade (Allemagne) : 1 629 (D-M) Schkopau (Allemagne) : 253 (M) |
| Inovyn (1 537) |
Anvers (Belgique) : 500 (M) Jemeppe (Belgique) : 174 (M) Stenungsund (Suède) : 123 (M) Rheinberg (Allemagne) : 220 (D-M) Tavaux (France) : 370 (M) Rosignano (Italie) : 150 (M) |
| Covestro (1 480) |
Dormagen (Allemagne) : 480 (M-HCl) Leverkusen (Allemagne) : 390 (M) Uerdingen (Allemagne): 290 (M) Brunsbuttel (Allemagne) : 220 (HCl) Tarragone (Espagne) : 100 (HCl) |
| Nobian
(1 222) |
Bitterfeld (Allemagne) : 99 (M) Ibbenbüren* (Allemagne) : 82 (M) Frankfurt (Allemagne) : 283 (M) Botlek (Pays Bas) : 637 (M) Delfzijl (Pays Bas) : 121 (M) |
Source : Euro Chlor
* : Le site de Ibbenbüren, exploité par Nobian, est propriété d’une joint-venture avec Evonik.
Fin 2017, quasiment toutes les électrolyse à cathode de mercure de l’Union européenne ont été converties ou arrêtées. L’usine suédoise de Stenungsund, en Suède, encore en fonctionnement a été convertie en janvier 2019. Sur 21 usines utilisant des cellules à cathode de mercure début 2017, 7 ont été fermées et 14 converties.
En juillet 2015, les groupes Ineos et Solvay ont regroupé leurs activités dans les produits chlorovinyliques, au sein de la joint venture 50/50 Inovyn qui est devenue, en juillet 2016, propriété du seul groupe Ineos.
Covestro est issu, depuis septembre 2015, de Bayer qui détient 64 % de la société.
Situation française
Production de dichlore : 790 998 t, en 2024.
Commerce extérieur : en 2024.
Les exportations étaient de 32 142 t avec comme principaux marchés à :
- 35 % la Belgique,
- 24 % la Hongrie,
- 15 % la Suisse,
- 14 % l’Allemagne,
- 4 % le Sénégal.
Les importations s’élevaient à 3 956 t en provenance principalement à :
- 36 % d’Italie,
- 36 % des Pays Bas,
- 14 % d’Espagne,
- 10 % d’Allemagne.
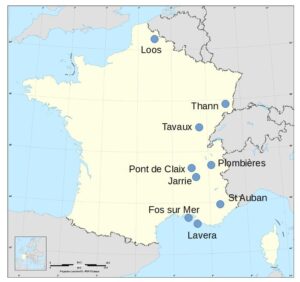
Producteurs, sites et capacités : ( ) type de cellules utilisées. M : membranes, D : diaphragme, Na : production de sodium.
Dans 7 usines productrices par 6 sociétés.
| Métaux spéciaux (MSSA) | Plombières (73) : 42 (Na) |
| Vynova PPC | Thann (68) : 42 (M) |
| Kem One | Fos (13) : 155 (M) Lavera (13) : 347 (M) |
| Arkema | Saint Auban (04) : 20 (M) |
| Kuhlmann (Tessenderlo) | Loos (59) : 38 (M) |
| Inovyn | Tavaux (39) : 370 (M) |
- Arkema a annoncé, en janvier 2025, l’arrêt à Jarrie (38) de la production de dichlore, avec une capacité de production de 75 000 t/an suite à la fin de son approvisionnement en chlorure de sodium par Vencorex.
- Vynova PPC ex Potasse et Produits Chimiques est une filiale du groupe International Chemical Investors. En 2015, les cellules à mercure ont été converties en cellules à membrane.
- Kem One a converti les cellules d’électrolyse de l’usine de Lavéra, en cellules à membrane, depuis mars 2017.
- Début 2014, Arkema a converti ses cellules d’électrolyse au mercure, en cellules à membrane.
- Kuhlmann, ex Produits chimiques de Loos (Tessenderlo) a converti les cellules à mercure en cellules à membrane avec une capacité de production augmentée à 38 000 t/an de dichlore.
- Vencorex, joint venture formée en 2012, entre PTT Global Chemical, groupe thaïlandais et Perstorp, groupe suédois est devenu, mi-2022, propriété du seul groupe PTT Global. Depuis septembre 2024, la société est en redressement judiciaire et cherche un repreneur. La capacité de production était de 118 000 t/an à Pont de Claix (38).
Usines françaises
Utilisations
Consommations : monde, en 2016, 70 millions de t, selon la répartition suivante, en 2019 : à 45 % en Chine, 17 % aux États-Unis, 12 % en Europe de l’Ouest, 5 % au Japon, 4 % dans le sous-continent indien.
France, en 2016 : 822 560 t.
Secteurs d’utilisation du dichlore
En 2024, en Europe, sur un total de 8,041 millions de t. Source : Euro Chlor
Secteurs d’utilisation : en 2024, en Europe.
| Isocyanates et oxygénates | 32,7 % | Autres produits organiques | 11,2 % | |
| PVC | 31,5 % | Solvants, épichlorhydrine, chlorométhanes et divers | 9,7 % | |
| Produits inorganiques | 15,6 % |
Source : Euro Chlor
Dans le monde, en 2017, le PVC représente 33 % de la consommation, les autres produits organiques, 21 %, le traitement de l’eau, 7 %, les intermédiaires chlorés, 6 %, la pâte à papier, 2 %, les autres produits inorganiques, 2 %.
La chimie organique absorbe plus de 80 % du dichlore produit.
Le dichlore est utilisé dans la fabrication de très nombreux produits chimiques et dans le commerce, on trouve plus de 15 000 produits chlorés.
85 % des produits pharmaceutiques fabriqués dans le monde utilisent du dichlore ou contiennent l’élément chlore.
96 % des produits phytosanitaires contiennent l’élément chlore.
Polymères contenant du chlore : le PVC : 57 % de sa masse est constituée par l’élément chlore. Il est obtenu par polymérisation du chlorure de vinyle monomère (CVM). Les unités de CVM sont implantées, en général, sur des sites produisant Cl2 et de l’éthylène (voir le chapitre PVC) ; le chlorure de polyvinylidène (CPVD), le polysulfure de phénylène, des élastomères synthétiques…
Polymères exempts de chlore : de nombreux autres polymères ne contiennent pas de chlore mais utilisent pour leur synthèse des produits élaborés à partir du dichlore, ce qui correspond à 20-25 % des consommations de dichlore.
- les polyuréthanes sont préparés à l’aide d’oxyde de propylène et d’isocyanate obtenu à partir de phosgène (COCl2),
- les polycarbonates utilisent le phosgène,
- les résines époxy emploient l’épichlorhydrine (CH2CHOCH2Cl),
- les polymères fluorés (polytétrafluoroéthylène (PTFE) connus sous le nom de marques déposées : Teflon, Hostaflon…) utilisent du chloroforme (CHCl3).
Synthèse du titane, du silicium et de la méthylcellulose.
Solvants chlorés : on assiste à une diminution importante de la consommation de chlore dans ce secteur (voir ce chapitre).
Pâte à papier : Cl2 est utilisé, particulièrement aux États-Unis et au Canada, comme agent de blanchiment des pâtes chimiques. Il forme des chlorolignites solubles dans la soude. Il est de plus en plus concurrencé par le chlorate de sodium, le peroxyde d’hydrogène et le dioxygène. En France, le dichlore n’est plus utilisé dans ce secteur depuis 1995.
Désinfection de l’eau potable : la désinfection finale est effectuée à l’aide de Cl2, à raison de 0,1 mg/L d’eau. Le traitement par le dichlore, au cours de traitement de l’eau, est, en général, effectué après élimination des composés organiques susceptibles de former des composés organochlorés (voir les chapitres eau et eau de Javel), sauf lors de traitements de choc en cas d’urgence. On estime que l’eau non purifiée est responsable de 25 000 morts par jour dans le monde.
Sécurité
Risques liés à l’inhalation du dichlore par voie respiratoire.
Employé comme gaz de combat lors de la 1ère guerre mondiale (la première fois le 22 avril 1915).
Au contact de la muqueuse rhino-pharyngée, le dichlore provoque un réflexe inhibiteur cardiorespiratoire avec bradycardie (ralentissement du cœur) et arrêt respiratoire à glotte fermée si l’intoxication est massive. Par ailleurs, pour toute inhalation importante, un œdème aigu du poumon est à redouter.
Effets de diverses concentrations, en ppm en volume :
- 0,25 ppm : seuil de perception olfactif,
- 5 ppm : légère irritation du nez et des voies aériennes supérieures,
- 15 à 20 ppm : irritation grave des voies aériennes supérieures, toux intense et suffocation,
- au-dessus de 50 ppm : perte de conscience et décès.
L’exposition à ce gaz ne doit donc pas excéder 0,5 ppm (valeur moyenne limite d’exposition (VME)).
Bibliographie
- Documents et statistiques du Syndicat des Halogènes et dérivés, Le Diamant A, 92909 Paris la Défense Cedex.
- Euro Chlor, rue Belliard 40, bos 15, B-1040 Bruxelles, Belgique.
- World Chlorine Council, 700 2nd Street, NE, Washington, DC 20002 États-Unis.
- J. Vallette, « Chlorine and building materials« , HBN, juillet 2018 et mars 2019.
- BAT Reference document for the production of chlor-alkali, European Commission, 2014.
- « Le chlore », 4ème édition, Syndicat des Halogènes et dérivés, octobre 1996.
- Livre blanc du chlore, éditeur : Jules Houtmeyers, président de Belgochlor, novembre 2004.
Archives
Acide sulfurique
Données physico-chimiques
Données atomiques
| Formule | Masse molaire | Moment dipolaire |
| H2SO4 | 98,08 g.mol-1 | 2,72 D |
Données physiques
| Masse volumique | Température de fusion | Température d’ébullition de l’acide à 98,3% (azéotrope) | Solubilité dans l’eau |
| 1,84 g.cm-3 | 10,36°C | 338°C | infinie |
Données chimiques
| pKa : H2SO4/HSO4– | pKa : HSO4– /SO42- |
pKs : Ag2SO4 |
pKs : BaSO4 | pKs : CaSO4 | pKs : Hg2SO4 | pKs : PbSO4 | pKs : RaSO4 | pKs : SrSO4 |
| -3,0 | 1,9 | 4,8 | 10 | 5,9 | 6,3 | 7,8 | 14 | 6,5 |
Potentiels standards :
| SO42- + 4H+ + 2e = H2SO3 + H2O | E° = 0,17 V |
| SO42- + H2O + 2 e = SO32- + 2OH– | E° = -0,93 V |
| S2O82- + 2e = 2SO42- | E° = 2,0 V |
| 2SO42- + 4H+ + 2e = S2O62- + 2H2O | E° = -0,2 V |
Données thermodynamiques
Acide sulfurique liquide
|
|
Données industrielles
L’acide sulfurique, appelé jadis huile de vitriol ou vitriol, est un composé chimique de formule H2SO4. C’est un acide fort complétement dissocié en solution aqueuse selon la réaction suivante :
H2SO4 + 2 H2O = 2 H3O+ + SO42-
Concentré, il est livré le plus souvent à une teneur de 96 %. Les statistiques sont généralement données en H2SO4 à 100 %.
Matières premières
Soufre (voir ce chapitre) ou dioxyde de soufre (voir ce chapitre).
En 2020, dans le monde, l’origine du soufre utilisé a été la suivante :
| Soufre élémentaire | 61 % | Grillage de pyrites et autres | 9 % | |
| Grillage de minerais de cuivre, zinc et nickel | 30 % |
Le soufre élémentaire provient principalement de la désulfuration du gaz naturel et du pétrole mais aussi marginalement de soufre natif, par exemple en Pologne. Lors du grillage des minerais de cuivre, de zinc et de nickel, le dioxyde de soufre produit est transformé en acide sulfurique. De même pour le grillage de pyrites, voir le chapitre soufre.
Fabrication industrielle
Essentiellement par le procédé de contact.
En général, le processus est en 3 étapes.
Première étape : fabrication de SO2.
Par combustion, entre 900 et 1100°C, du soufre liquide divisé en fines gouttelettes dans de l’air sec en excès :
S + O2 = SO2 ΔrH°298 = – 297 kJ/mole
Le mélange gazeux après combustion a une teneur de 8 à 12 % en volume de SO2 et sa purification n’est pas nécessaire.
Le grillage de sulfures métalliques (voir les chapitres consacrés au zinc et au plomb) donne directement du dioxyde de soufre.
Deuxième étape : formation de SO3 par le procédé de contact ou procédé Bayer.
L’oxydation de SO2 est réalisée par le dioxygène de l’air, à 410-440°C, en présence de catalyseurs :
SO2 + 1/2 O2 = SO3 ΔrH°298 = – 99 kJ/mole
L’oxydation étant exothermique, la réaction amorcée à environ 430°C atteint rapidement 600°C. Avant introduction dans le lit de catalyseur suivant, le gaz formé est refroidi à 430°C.
Le catalyseur (de l’ordre de 80 t par réacteur) est constitué de kieselguhr (diatomite) imprégné d’un mélange de VOSO4 et KHSO4 qui donne V2O5 lors de l’oxydation de SO2. Les ions K+ sont actuellement remplacés, partiellement, par des ions Cs+.
L’oxydation a lieu par passage à travers 4 ou 5 lits de catalyseur montés en série :
- Par simple contact : 60 % du SO2 est oxydé après le 1er lit, 90 % après le 2ème, 98 % après le 4ème. Ensuite le SO3 formé, refroidi à 200°C, est absorbé dans de l’acide sulfurique à 98,5 % (voir ci-dessous).
- Par double contact : une amélioration du procédé Bayer consiste à réaliser une double absorption. Après le 2ème ou le 3ème lit, le SO3 formé est absorbé dans H2SO4 à 98,5 %. Le gaz restant est chauffé à 480°C puis passe à travers un 3ème, 4ème ou 5ème lit. Le rendement final est supérieur à 99,6 %. Ce procédé permet de réduire à 350 ppm la teneur en SO2 du gaz rejeté dans l’atmosphère.
La teneur en dioxyde de soufre des gaz rejetés peut être diminuée, jusqu’à 15 ppm, en utilisant le procédé sulfacid qui consiste à traiter les gaz produits, en présence d’eau, par adsorption sur du charbon actif. On obtient de l’acide sulfurique dilué, avec une concentration comprise entre 10 et 20 %, qui peut être recyclé. Ce procédé est utilisé par l’OCP pour deux de ses unités de production d’acide sulfurique, à Jorf Lasfar et Safi, au Maroc.
La production de H2SO4 à partir de soufre génère de l’énergie avec 5,7 GJ/t de H2SO4 à 100 %. Environ 60 % de cette énergie est utilisée pour produire de la vapeur d’eau.
Troisième étape : formation de H2SO4.
SO3 + H2O = H2SO4 ΔrH°298 = – 132,4 kJ/mole
SO3 se dissout difficilement dans l’eau mais par contre il est soluble dans l’acide sulfurique concentré en donnant des oléums. L’acide commercial à 78, 96 ou 98 % est obtenu par dilution des oléums formés.
Les unités de production ont des capacités qui peuvent atteindre 5 000 t/jour avec par exemple les deux unités de production de l’OCP, à Jorf Lasfar, au Maroc.
Pour produire 1 000 t de H2SO4 à 100 %, il faut environ :
| Soufre | Eau | Air | Électricité |
| 338 t | 2 500 m3 | 3 millions de m3 | 45 000 kWh |
Évolution de la production selon les procédés : en France, en milliers de t de H2SO4 à 100 %.
L’ancien procédé, aux chambres de plomb, a été supplanté par le procédé de contact.
| Année | Production | Chambres de plomb | Procédé de contact |
| 1954 | 1 378 | 55 % | 45 % |
| 1970 | 3 596 | 11 % | 89 % |
| 1974 | 4 577 | 6 % | 94 % |
| 1975 | 3 664 | 5 % | 95 % |
| 1979 | 4 848 | 1 % | 99 % |
| 1991 | 3 080 | ||
| 1996 | 2 566 | 0 | 100 % |
| 2010 | 750 | 0 | 100 % |
| 2020 | 526 | 0 | 100 % |
La diminution de la production française a été principalement liée à l’arrêt de la production d’acide phosphorique et d’engrais phosphatés, la dernière usine ayant fermé en 2004.
Productions
En 2019, la production mondiale a été de 281 millions de t, celle de l’Union européenne, en 2024, de 14,945 millions de t.
Estimation des productions dans les principaux pays :
| Chine, en 2021 | 93 800 | Maroc, en 2017 | 7 000 | |
| États-Unis, en 2017 | 40 000 | Japon, en 2021 | 6 118 | |
| Inde, en 2017 | 16 000 | Allemagne, en 2024 | 2 827 | |
| Russie, en 2017 | 14 000 |
Sources : Eurostat, Statistics Bureau of Japan
En Inde, en 2018, il y a 65 usines de production.
Productions, en 2024, dans l’Union européenne sur un total de 14,945 millions de t.
| Allemagne | 2 827 | Finlande | 1 089 | |
| Espagne | 2 026 | Suède, en 2022 | 595 | |
| Italie | 1 999 | France | 566 | |
| Pologne | 1 354 | Autriche, en 2023 | 485 | |
| Belgique | 1 189 | République tchèque | 306 |
La production de la Bulgarie, producteur important, est confidentielle.
Commerce international : en 2024.
Le commerce mondial avec environ 20 millions de t/an est limité, par rapport à la production, car les utilisateurs, en particulier les producteurs d’engrais phosphatés, produisent eux-même, en grande partie, l’acide en important du soufre.
Principaux pays exportateurs.
| Japon | 3 437 | Bulgarie | 1 128 | |
| Chine | 2 683 | Mexique | 1 061 | |
| Corée du Sud | 2 452 | Allemagne | 1 032 | |
| Canada | 1 746 | Belgique | 658 | |
| Pérou | 1 147 | Russie | 542 |
Les exportations japonaises sont destinées à 39 % aux Philippines, 15 % à l’Inde, 14 % au Chili, 9 % à l’Indonésie.
Principaux pays importateurs sur un total mondial de 21,626 millions de t.
| Chili | 3 614 | Indonésie | 1 083 | |
| États-Unis | 3 482 | Turquie | 882 | |
| Inde | 1 785 | Arabie Saoudite | 762 | |
| Maroc | 1 711 | Thaïlande | 626 | |
| Philippines | 1 417 | Kazakhstan | 592 |
Les importations chiliennes proviennent à 34 % de Chine, 31 % du Pérou, 13 % de Corée du Sud, 12 % du Japon, 6 % du Mexique.
Producteurs :
Les principaux producteurs sont d’une part les producteurs d’engrais phosphatés, (Office Chérifien des Phosphates (OCP), Mosaic, Nutrien, PhosAgro, Eurochem, Groupe Chimique Tunisien (GCT)) ainsi que les groupes chimiques pour leurs propres besoins et d’autre part les groupes métallurgiques produisant du cuivre, du zinc, du plomb, du nickel… à partir de minerais sulfurés.
Les producteurs d’engrais et les groupes chimiques auto-consomment, en général, l’acide produit, alors que les groupes métallurgiques sont les principaux pourvoyeurs d’acide sur le marché. Par exemple :
- Le groupe Glencore produit de l’acide sulfurique, au Canada, à partir du grillage de minerais sulfurés de cuivre, nickel, plomb et zinc. La commercialisation de l’acide produit en Ontario à Sudbury INO lors du grillage de minerais de nickel et de cuivre, au Québec lors du grillage de minerai de cuivre avec la Fonderie Horne à Rouyn-Noranda qui produit 640 000 t/an d’acide et lors du grillage de minerai de zinc avec l’affinerie CEZinc à Salaberry de Valleyfield qui produit 400 000 t/an d’acide est assurée par Norfalco, filiale de Glencore, avec 2 millions de t/an.
- En Europe, les principaux producteurs sont : Aurubis avec 2,296 millions de t en 2021-22, en Allemagne à Hambourg et en Bulgarie, à Pirdop, Acideka, en Espagne, Nuova Solmine, en Italie, à Scarlino avec 600 000 t/an et Serravalle Scriva avec 75 000 t/an d’acide régénéré, Boliden, avec une capacité de production de 1,7 million de t/an à Rönnskar, en Suède, Harjavalta et Kokkola en Finlande et Odda, en Norvège, BASF, en Allemagne à Ludwigshafen et en Belgique à Anvers, avec, en 2016, 920 000 t/an de capacité mondiale de production d’acide sulfurique, Ineos, Prayon, en Belgique.
Recyclage
H2SO4 régénéré est obtenu à partir d’acide résiduaire ou de dérivés soufrés provenant des industries chimiques et parachimiques. Cet acide provient principalement des unités d’alkylation utilisées pour produire de l’essence sans plomb dans lesquelles l’acide sulfurique sert de catalyseur mais aussi des unités de sulfonation, du séchage et de la purification des gaz… L’acide utilisé est régénéré puis recyclé.
Parmi l’acide recyclé, il faut prendre en compte celui employé par l’hydrométallurgie de minerais (cuivre, zinc…). Dans ce cas, l’acide est directement recyclé sans régénération.
Principe de la régénération : l’acide, en présence d’air, de soufre et de fuel est craqué dans un four vers 1000°C et transformé en SO2. Le gaz produit est lavé à l’acide sulfurique dilué, filtré et séché à l’acide sulfurique à 93 % puis, le SO2 est oxydé par conversion catalytique en SO3 qui dans une tour d’absorption donne l’acide sulfurique.
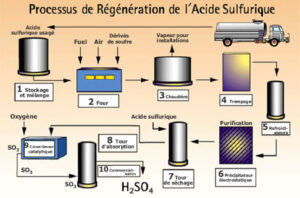
Document Rhodia Eco Services
L’acide régénéré est proposé à un prix compétitif en regard des coûts alternatifs de neutralisation et de mise en décharge des acides usés.
En 2012, la production d’acide régénéré, aux États-Unis, se situe entre 2,5 et 5 millions de tonnes.
Producteurs d’acide régénéré :
EcoServices, ex-Rhodia et Solvay, société du groupe PQ Corporation, est le premier producteur mondial d’acide sulfurique régénéré. Les unités de production d’acide sulfurique, qui représentent plus de la moitié des capacités de production du pays, sont toutes situées aux États-Unis, à Hammond dans l’Indiana, Bâton Rouge en Louisiane, Baytown et Houston au Texas, Dominguez et Martinez en Californie. La production est de plus d’un million de tonnes d’acide sulfurique régénéré par an.
Aux États-Unis, Veolia, exploite une usine de régénération d’acide sulfurique à Darrow, en Louisiane et des unités sur des sites pétroliers, à Delaware City, dans le Delaware, El Paso au Texas et Elizabeth dans le New Jersey.
En France, Adisseo, exploite une unité de régénération sur son site des Roches de Condrieu (38).
Situation française
Production : 566 252 t, en 2024.
Commerce extérieur : en 2024.
Les exportations étaient de 139 579 t avec comme principaux marchés à :
- 63 % la Belgique,
- 15 % l’Espagne,
- 6 % l’Algérie,
- 5 % l’Allemagne.
Les importation s’élevaient à 303 332 t en provenance principalement à :
- 34 % d’Allemagne,
- 25 % de Belgique,
- 20 % d’Espagne,
- 10 % d’Italie.
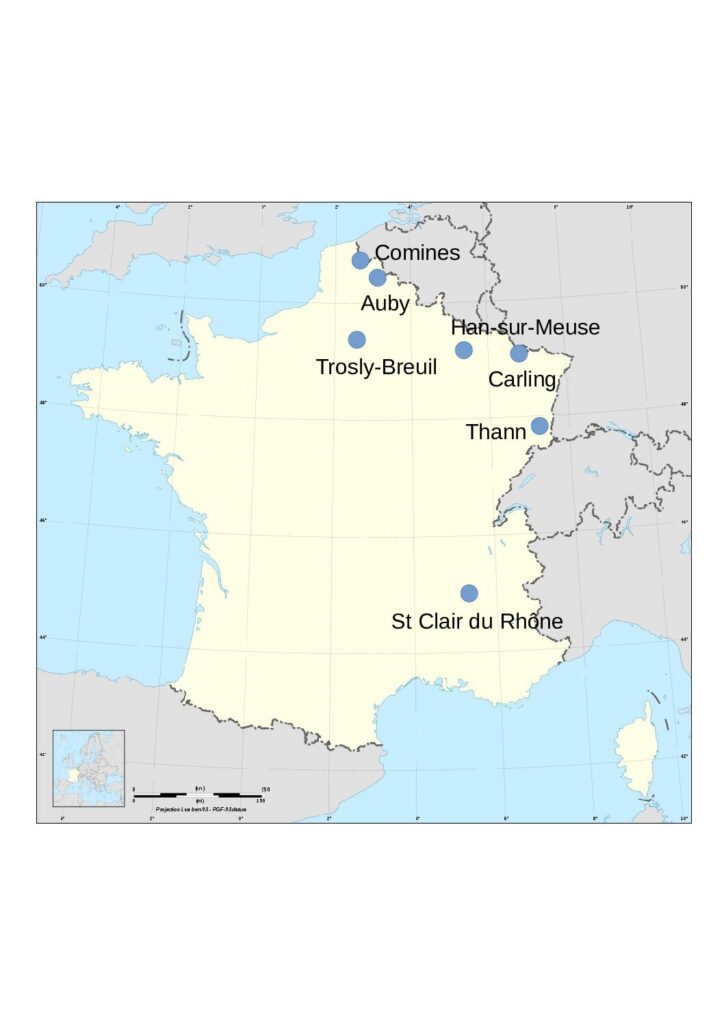
Producteurs et unités de production :
- Adisseo, filiale du groupe chinois Bluestar, à Saint Clair du Rhône (38), pour la production de méthionine (voir le chapitre sulfate de sodium), avec une capacité de production de 250 000 t/an.
- Nyrstar, à Auby (59), provenant du grillage de minerais de zinc (voir le chapitre zinc), avec une capacité de production de 200 000 t/an et une production, en 2018, de 167 000 t.
- Arkema, à Carling/Saint Avold (57), avec une capacité de production de 190 000 t/an.
- WeylChem Lamotte, à Trosly-Breuil (60), avec une capacité de production de 130 000 t/an.
- Tronox qui a acquis, en février 2017, les activités de la société Cristal, dans la production de dioxyde de titane à Than (68), avec une capacité de production de 86 000 t/an.
- Venator Pigments France à Comines (59), société issue du groupe Huntsman, qui synthétise des pigments bleus d’outremer avec une capacité de production inférieure à 10 000 t/an.
- Innospec Performance Chemicals à Han-sur-Meuse (55) avec une capacité de production de l’ordre de 3 000 t/an.
Localisation des usines françaises de production d’acide sulfurique
Utilisations
Consommation : en 2021, la consommation mondiale est de 287,7 millions de t avec, en 2020, la répartition suivante :
| Chine continentale | 35 % | Amérique latine | 7 % | |
| Amérique du Nord | 13 % | Europe de l’Est | 7 % | |
| Afrique | 12 % | Moyen Orient | 6 % |
Source : IHS Markit
Secteurs d’utilisation : dans le monde, en 2020.
| Engrais phosphatés | 57 % | Extraction de métaux | 8 % | |
| Produits chimiques | 13 % |
Utilisations diverses :
- L’industrie des engrais pour la fabrication de l’acide phosphorique (voir le chapitre consacré aux engrais phosphatés).
- La fabrication de l’acide phosphorique pour l’élaboration de phosphates destinés à l’alimentation animale ou humaine et de tripolyphosphates utilisés dans les détergents (voir le chapitre consacré à l’acide phosphorique).
- La fabrication du dioxyde de titane selon le procédé sulfurique. TiO2 est le principal pigment blanc utilisé dans les peintures.
- L’hydrométallurgie du zinc et du cuivre.
- La fabrication du caprolactame, du polyamide utilisés comme textiles.
- Le traitement de la pâte à papier.
- La fabrication de l’acide fluorhydrique.
- L’alkylation pour la production d’essence sans plomb.
- Pour le séchage et la purification des gaz.
- Pour le détartrage. Par exemple, le détartrage des 2,4 km2 d’aéroréfrigérants à tirage naturel des centrales électriques thermiques classiques ou nucléaires nécessite de 10 à 20 t/jour d’acide sulfurique à 98 %.
- La fabrication du papier sulfurisé par trempage de papier buvard dans de l’acide concentré. Les fibres sont partiellement solubilisées en formant un gel de cellulose qui précipite en bouchant les pores.
- Comme additif alimentaire, E 513, sous forme diluée.
- Le décapage des métaux.
- Comme électrolyte des batteries au plomb.
- Pour la production de TNT, de nitroglycérine, d’acide picrique et autres acides minéraux.
- Dans le traitement des eaux.
Risques et précautions d’emploi
Les principaux risques sont les suivants :
- L’acide sulfurique provoque des brûlures de la peau et des lésions oculaires graves avec risque de perte de la vue. Les risques sont d’autant plus importants que l’acide est concentré.
- Il peut irriter les voies respiratoires.
- En cas d’ingestion il peut entraîner des lésions de la bouche, de l’œsophage et du tube digestif. Il y a risque de perforation pour l’œsophage et l’estomac.
L’acide sulfurique réagit violemment avec l’eau avec un dégagement de chaleur important qui peut localement porter l’eau à ébullition. Cela peut se produire lorsque de l’eau est versée sur de l’acide concentré. L’eau étant moins dense que l’acide, la réaction se produit en surface et peut entraîner des projections d’acide. Pour cette raison, pour diluer de l’acide sulfurique, il faut toujours verser l’acide dans l’eau et non l’inverse. L’acide, plus dense, sa densité par rapport à l’eau est de 1,84, coule au fond du récipient et la réaction exothermique a lieu au sein du liquide au lieu de sa surface et les projections sont évitées.
Il réagit également violemment avec de nombreux composés et en particulier avec les cristaux de permanganate de potassium. Pour préparer une solution acide de permanganate de potassium, il faut au préalable dissoudre les cristaux de permanganate dans l’eau puis ensuite introduire l’acide sulfurique. Ne jamais mettre en contact les cristaux de permanganate avec l’acide concentré, il y a risque d’explosion violente.
Bibliographie
- Association des Entreprises de la Chimie Minérale (Adechim), France Chimie, Le Diamant A, 92909 Paris la Défense Cedex.
- « Sulfuric acid supply/demand fundamentals », Glencore, 22 mai 2017.
- European Sulphuric Acid Association (ESA), Av. van Nieuwenhuyse, 4/2, B-1160 Bruxelles, Belgique.
- Sulfuric Acid on the WebTM.
- International Fertilizer Industry Association (IFA), 15 rue Marbeuf, 75008 Paris.
- INRS, Fiche toxicologique n°30 : Acide sulfurique.
Archives
Dioxyde de soufre
Données physico-chimiques
Données atomiques
| Formule | Masse molaire | Distance interatomique : S-O | Angle O-S-O | Moment dipolaire |
| SO2 | 64,06 g.mol-1 | 143 pm | 119,5° | 1,663 D |
Données physiques
| Masse volumique | Température de fusion | Température d’ébullition | Température critique | Pression critique | Température point triple | Pression point triple | Conductibilité thermique | Solubilité dans l’eau |
|
-72,7°C | -10°C | 157,49°C | 7 884 kPa | -75,45°C | 16,74 kPa | 8,43 W.m-1K-1 |
|
Données chimiques
| pKa : H2SO3/HSO3– | pKa : HSO3– /SO32- | |
| 1,8 | 7,2 |
Potentiels standards :
| SO42- + 4H+ + 2e = H2SO3 + H2O | E° = 0,17 V |
| SO42- + H2O + 2e = SO32- + 2OH– | E° = -0,93 V |
| S2O62- + 4H+ + 2e = 2H2SO3 + H2O | E° = 0,6 V |
| 2H2SO3 + H+ + 2e = HS2O4– + 2H2O | E° = -0,08 V |
| 2SO32- + 2H2O + 2e = S2O42- + 4OH– | E° = -1,12 V |
| 2H2SO3 + 2H+ + 4e = S2O32- + 3H2O | E° = 0,40 V |
| 2SO32- + 3H2O + 4e = S2O32- + 6OH– | E° = -0,58 V |
| SO32- + 3H2O + 4e = S(s)+ 6OH– | E° = -0,66 V |
Données thermodynamiques
Dioxyde de soufre gazeux :
|
Dioxyde de soufre liquide :
|
Données industrielles
Les teneurs moyennes de l’atmosphère en dioxyde de soufre (SO2) observées, en France métropolitaine et DOM, en 2016, sont de 2,8 µg.m-3 en zone industrielle et 1,9 µg.m-3 en zone urbaine avec un maximum de 15 µg.m-3 en milieu industriel et 12 µg.m-3 en milieu urbain. Elles étaient respectivement, en moyenne, de 54 et 2 µg.m-3 en 2000.
Pour l’Île de France, la moyenne annuelle, en 2019, et depuis 2009, est inférieure à la limite de détection de 5 µg.m-3 (la valeur était de 27 µg.m-3 en 1991 et de 364 µg.m-3 en 1958).
Les émissions totales, dans le monde, de SO2 étaient estimées, en 2005, à 135 millions de t, dont 115 millions de t dues aux émissions anthropogéniques (humaines). En 2016, les émissions anthropogéniques ont baissé pour atteindre 100 millions de t.
Émissions naturelles : par les volcans, estimées, en moyenne, à 4 millions de t/an et par les eaux côtières (par oxydation du diméthylsulfure produit par des bactéries). L’émission dans l’atmosphère par le volcan Pinatubo (Philippines), du 11 au 15 juin 1991, a été estimée à 20 millions de t de SO2. L’éruption volcanique du Bároarbunga, en Islande, du 31 août 2014 jusqu’en février 2015, a émis 11±5 millions de t, soit journellement 3 fois plus que les émissions anthropogéniques européennes.
Émissions humaines : principalement par l’utilisation de combustibles contenant du soufre (le soufre est oxydé en dioxyde de soufre), particulièrement pour la production d’électricité et lors du traitement de minerais sulfurés (galène, blende, pyrite, minerais de cuivre, de nickel…).
Teneurs en soufre de quelques combustibles et carburants : en % pondéral.
- Charbon pauvre en S : inférieure à 1 %.
- Charbon riche en S : de 2 à 5 %.
- Pétrole brut : varie de moins de 0,5 % pour les pétroles à très basse teneur (par exemple le pétrole algérien) à plus de 3 % pour les pétroles à très haute teneur.
- Fuel lourd : 3 %.
- Essence et carburant diesel : inférieure à 10 ppm (10 mg/kg), en France depuis le 1er janvier 2009.
- Fuel domestique : inférieure à 0,10 %, en France, depuis le 1er janvier 2008.
- Propane : inférieure à 0,005 %.
Quantités de SO2 émises par les activités humaines dans quelques pays : en 2018, Union européenne : 2,117 millions de t.
| Inde, en 2016 | 11 100 | France | 136 | |
| Chine, en 2016 | 8 400 | Italie | 110 | |
| Russie | 3 703 | République tchèque | 96 | |
| États-Unis | 2 111 | Grèce | 65 | |
| Turquie | 2 528 | Islande | 55 | |
| Australie | 2 121 | Portugal | 45 | |
| Kazakhstan, en 2016 | 1 796 | Belgique | 38 | |
| Canada | 812 | Finlande | 33 | |
| Japon | 694 | Pays Bas | 24 | |
| Pologne | 501 | Suède | 17 | |
| Allemagne | 289 | Norvège | 16 | |
| Espagne | 197 | Irlande | 12 | |
| Royaume Uni | 159 | Suisse | 5 |
Les émissions dues au transport maritime international sont estimées, en 2005, à 12 millions de t.
Évolutions :
Après une augmentation régulière des émissions depuis la révolution industrielle, la diminution des émissions est générale depuis 1980, sauf en Chine où la décroissance a commencé en 2007 et en Inde où la croissance se poursuit. Dans le monde, les émissions qui étaient estimées à 20 millions de t en 1900, atteignent un maximum de 131 millions de t en 1980, décroissent jusqu’à 108 millions de t, en 2000, pour remonter, sous la pression chinoise, à 115 millions de t, en 2005 et ensuite décroitre, avec la décroissance chinoise, à 100 millions de t, en 2016.
De 2007 à 2016, les émissions chinoises ont diminué de 75 %, passant de 36,6 millions de t à 8,4 millions de t alors que celles de l’Inde ont augmenté de 50 % passant à 11,1 millions de t.
Dans l’ensemble des pays constituant actuellement l’Union européenne, à 28, les émissions sont passées de 25,4 millions de t, en 1990 à 2,3 millions de t en 2017 soit une diminution de 91 %.
En France métropolitaine, les émissions sont passées d’un maximum de 3,598 millions de t, en 1973, à 1,207 million de t, en 1990 et 114 000 t en 2019.
Aux États-Unis, les émissions sont passées de 17,3 millions de t, en 1980, à 2,489 millions de t, en 2017.
Répartition des émissions : en 2019.
| Industries manufacturières et construction | 40 % | Extraction et distribution du pétrole et gaz naturel | 11 % | |
| Transformations de l’énergie | 23 % | Industries métallurgiques | 5,0 % | |
| Résidentiel, tertiaire, agriculture | 14 % | Transport | 3,1 % |
Dans l’Union européenne, en 2017, la production et distribution d’énergie représente 48 % des émissions, l’industrie, 32 %.
Aux États-Unis, en 2016, 44 % des émissions provient de la production d’électricité, principalement à partir de charbon. Les autres activités industrielles comptent pour 43 %.
En Chine, 85 % des émission provient de la combustion de charbon, 9 % des activités industrielles, 3 % du raffinage pétrolier, 1 % de la combustion de biomasse.
Rôle industriel
Le dioxyde de soufre est principalement un produit intermédiaire dans l’élaboration de l’acide sulfurique (voir ce chapitre). Il est obtenu par combustion du soufre, en présence d’air ou récupéré lors du grillage de divers sulfures métalliques tels que ceux de zinc, plomb, cuivre, nickel… (voir les chapitres correspondant à ces différents métaux).
Il intervient dans le procédé Claus de traitement du gaz naturel (voir le chapitre soufre).
Il est aussi utilisé comme désinfectant et antiseptique, en particulier dans l’alimentation (voir en fin de chapitre son utilisation en vinification).
Rôle sur la santé humaine
La présence simultanée de SO2 et de fines particules (fumées noires) en suspension dans l’air, à des teneurs supérieures à 500 µg.m-3 pour chacun des polluants peut causer des troubles graves de la respiration. SO2 joue un rôle essentiel dans la formation des smogs acides. Ceux-ci se forment par temps calme, en présence d’un anticyclone, par inversion atmosphérique : une couche d’air chaud se place au-dessus d’une couche d’air froid polluée par de la fumée, du SO2 et du brouillard. Le smog de Londres du 4 décembre 1952 a ainsi causé la mort de 4 000 à 8 000 personnes. Le smog photochimique, du type de celui de Los Angeles, se produit par beau temps et trouve son origine dans les hydrocarbures imbrûlés et les oxydes d’azote (pollution automobile) qui produisent de l’ozone.
La pollution par le dioxyde de soufre, outre des troubles de respiration, peut entraîner des risques cardiovasculaires pour des personnes fragiles. Une étude du réseau national de santé publique réalisée entre 1987 et 1990 en région parisienne et publiée en février 1996 indique, pour cette région, 54 décès prématurés par maladies respiratoires et 344 par maladies cardiovasculaires dus à la pollution par le dioxyde de soufre.
Les recommandations de l’O.M.S. sont les suivantes :
- Teneurs inférieures à 500 µg.m-3 pour des durées d’exposition maximales de 10 minutes.
- Teneurs inférieures à 20 µg.m-3 pendant des durées de 24 heures.
Pluies et dépôts acides
La pluie et la neige sont naturellement acides (pH = 5,6, conséquence de la dissolution du CO2 de l’atmosphère). Mais outre CO2, SO2 et les oxydes d’azote (NO, et NO2, notés NOx) sont également solubles dans les fines gouttelettes d’eau de la base des nuages (celle-ci est de 3 à 30 fois plus concentrée en acides que les pluies formées). SO2 est acide en solution aqueuse et, de plus, par oxydation il donne de l’acide sulfurique, NOx donne de l’acide nitrique. On considère qu’une pluie est acide lorsque son pH est inférieur à 5,6.
En 1980, en France, l’acidité était, en moyenne, due à 53 % à SO2, 23 % aux NOx, 25 % à l’ammoniac et à un moindre degré aux acides chlorhydrique et fluorhydrique. Ces dernières années, en France métropolitaine, avec la diminution de la pollution par SO2, la part de ce dernier n’est plus, en 2017, que de 7,5 % avec 30 % pour les oxydes d’azote et 62 % pour l’ammoniac. L’acidité des pluies est comptée en équivalent acide (Aeq), avec 1 g d’Aeq correspondant à 32 g de SO2, 46 g de NOx ou 17 g de NH3. Entre 1980 et 2017, en France métropolitaine la valeur de l’Aeq est passée de 186 kt à 60 kt.
Dans le monde, quelques valeurs exceptionnelles d’acidité des pluies ont été atteintes :
- Un pH de 1,69 a été atteint en 1983 dans un brouillard, en Californie.
- Le pH annuel moyen de 3,78 a été enregistré en 1967 à De Bier (Pays Bas).
Outre leur présence dans la pluie, SO2, NH4+ et NOx peuvent être fixés par les particules solides présentes dans l’atmosphère. On parle alors de dépôt acide.
Outre leur rôle sur l’acidification des lacs et le dépérissement des forêts (voir ci-dessous), les pluies acides participent à la détérioration du calcaire des bâtiments et statues en pierre. L’acier est également attaqué avec formation de sulfate de fer soluble dans l’eau.
Rôle sur l’acidification des lacs :
Les lacs d’eau douce à soubassement rocheux très siliceux (cas fréquent au Canada et en Scandinavie) ont un faible pouvoir tampon (on parle de faible capacité de neutralisation acide). Les précipitations acides sur ces lacs peuvent entraîner une diminution du pH. Lorsque le pH devient inférieur à 5, les populations de poisson diminuent considérablement ou disparaissent. Il a été calculé qu’une eau douce contenant 1,7 mg de Ca2+/L, de pH 6,5, voit ses poissons disparaître lorsque la moyenne à long terme, du pH des précipitations est inférieure à 4,3.
Rôle sur le dépérissement des forêts :
Lorsque les teneurs en SO2 de l’atmosphère sont très élevées, les arbres des forêts proches peuvent mourir. Cela a été le cas dans les Monts Métallifères, à la frontière Allemagne-République tchèque : plusieurs centaines de milliers d’hectares ont été détruits par la pollution due à la combustion dans des centrales thermiques de lignite riche en soufre.
Dans le cas des forêts d’Allemagne et de France, SO2, un temps incriminé, semble ne pas être la cause directe de la défoliation des arbres. Les facteurs les plus importants semblent être : les variations de climat (sécheresse, froid), la pauvreté des sols (carences en Mg2+, K+), l’action de l’ozone. L’acidité des pluies participe au dépérissement, en rendant plus fragile des arbres affaiblis par ailleurs par d’autres agressions et en entraînant les ions Mg2+ et K+ du sol ce qui peut occasionner des carences dans des sols acides.
Normes françaises
On distingue des valeurs limites horaires et journalières de concentration dans l’air et un objectif de qualité annuel.
- Valeur limite horaire : elle est de 350 μg/m3 à ne pas dépasser plus de 24 fois par an.
- Valeur limite journalière : elle est de 125 μg/m3 à ne pas dépasser plus de 3 jours par an.
- Objectif de qualité en moyenne annuelle : inférieur à 50 μg/m3.
Par ailleurs, un seuil de recommandation et d’information est situé à 300 μg/m3 en moyenne horaire et un seuil d’alerte à 500 μg/m3 sur 3 heures consécutives.
Moyens de lutte contre les émissions de SO2
On peut agir par :
- Diminution de la teneur en soufre des combustibles. Par exemple, à compter du 1er janvier 2020, le fuel maritime a vu sa teneur en soufre passer de 3,5 à 0,5 %.
- Fixation du SO2 formé, dès la combustion, en injectant dans le foyer de combustion du calcaire ou de la chaux. La technique du lit fluidisé permet, en limitant la température de combustion à 850°C, d’atteindre des rendements de désulfuration de l’ordre de 90 %.
- Désulfuration des fumées produites lors de la combustion par lavage humide à l’aide de calcaire ou de chaux, ou de solutions ammoniacales (voir le chapitre sulfate de calcium).
- Autres traitements des fumées, avec formation de H2SO4 qui peut être récupéré : par oxydation catalytique (en présence de O2 et H2O, procédé Sulfacid) ou par oxydation à l’aide de H2O2 (procédé Peracidox).
Le traitement de désulfuration des gaz de combustion est, en général, associé à une filtration qui élimine en grande partie les poussières émises. Les conséquences de ces traitements ne peuvent qu’être bénéfiques pour la santé humaine. Toutefois, la diminution importante des émissions de poussières (en général basiques) qui neutralisent l’acidité du SO2 nécessite une élimination d’autant plus importante des émissions de SO2 pour que celles-ci soient sans effet sur l’acidification des lacs et le dépérissement des forêts. Par ailleurs, le SO2 présent dans l’atmosphère, fixé ou non sur des poussières, a un effet bénéfique sur les cultures, en particulier sur des sols très calcaires. Les retombées atmosphériques, comptées en SO3, ont chuté, en France, de 91 à 23 kg/ha entre 1973 et 1996 ce qui a entraîné des carences en élément soufre, pour la culture du blé, dans des régions très calcaires.
Le dioxyde de soufre en vinification
En général, les vins sont traités à l’aide de dioxyde de soufre en cours de vinification puis pour leur conservation. SO2 est antiseptique et réducteur.
- Il empêche le développement de micro-organismes (levures, bactéries) et évite ainsi diverses fermentations indésirables telles que, par exemple, la fermentation acétique.
- Il préserve les composants du vin de l’oxydation, en particulier celle de polyphénols et d’éléments de l’arôme. Il prévient la madérisation.
Au pH du vin (entre 2,8 et 3,6), en solution, SO2 est principalement sous forme d’ion hydrogénosulfite HSO3– selon l’équilibre :
SO2 + H2O = HSO3– + H+ avec un pK1 = 1,81
C’est principalement SO2 « libre » qui possède des propriétés antiseptiques.
Pour un vin de pH 2,8, 10 % du SO2 n’est pas ionisé en HSO3–. A pH 3,8 seulement 1 % du SO2 reste « libre ». Par ailleurs, une partie du SO2 introduit réagit avec divers constituants du vin (éthanol, sucres…). Les vins blancs doux (par exemple le Sauternes), riches en sucre, doivent être traités par des quantités plus importantes de SO2.
Doses de SO2 utilisées : en mg de SO2/L de vin.
- Vins rouges : 5 à 20.
- Vins blancs secs : 20 à 40.
- Vins blancs doux : 60 à 100.
Des doses trop fortes donnent l’odeur piquante et irritante caractéristique du SO2 et neutralisent le bouquet du vin. Des doses trop faibles ne protègent pas le vin du développement de levures.
Formes d’introduction du SO2 :
- Gazeuse à partir de bouteilles de SO2 liquide, sous pression (3 atm à 20°C).
- En solution aqueuse de SO2 : 50 à 80 g de SO2/L de solution.
- En solution aqueuse concentrée d’hydrogénosulfite de potassium (KHSO3).
- A l’aide de pyrosulfite (ou métabisulfite) de potassium solide (K2S2O5).
- Par combustion de plaques de soufre, vieille technique du méchage des fûts en bois.
Évolution : la tendance est à la diminution de la teneur des vins en SO2 afin de préserver au mieux le bouquet, en améliorant les conditions d’hygiène lors de la vinification afin de protéger les installations et le matériel de contaminations par des micro-organismes.
Bibliographie
- Centre Interprofessionnel Technique d’Études de la Pollution Atmosphérique (CITEPA), 42 rue du Paradis, 75010 Paris.
- AirParif, 7 rue Crillon, 75004, Paris.
- US Environmental Protection Agency (EPA), Ariel Rios Building, 1200 Pennsylvania Avenue, N.W. Washington DC 20460.
- « Air quality in Europe« , EEA report n°10/2019.
- S.J. Smith et al, « Anthropogenic sulfur dioxide emissions: 1850–2005« , Atmos. Chem. Phys.,11, 2011, 1101-16.
- Lignes directrices OMS relatives à la qualité de l’air : particules, ozone, dioxyde d’azote et dioxyde de soufre, OMS, 2005.
- Inventaire des émissions de polluants atmosphériques et de gaz à effet de serre en France, séries sectorielles et analyses étendues, format Secten, CITEPA, juin 2016.
- European Monitoring and Evaluation Programme (EMEP).
- BUP, n°737, octobre 1991, n°790-791, janvier-février 1997 (p 149-150 et 160-161).
- J. et P. Ribéreau-Gayon, E. Peynaud, P. Sudraud, Sciences et techniques du vin, Dunod, 1972, 1976 et 1977.
Archives
Sulfure d’hydrogène
Données physico-chimiques
Données atomiques
| Formule | Masse molaire | Distance interatomique : H-S | Angle : H-S-H | Moment dipolaire |
| H2S | 34,08 g.mol-1 | 135 pm | 93,3° | 0,9783 D |
Données physiques
| Masse volumique | Température de fusion | Température d’ébullition | Température critique | Pression critique | Température point triple | Pression point triple | Température d’auto-inflammation | Limites d’explosivité dans l’air | Conductibilité thermique | Solubilité dans l’eau |
| à 15°C, 101,3 kPa : 1,453.10-3 g.cm-3 |
-85,5°C | -60,7°C | 99,95°C | 9 006 kPa | -85,45°C | 23,2 kPa | 270°C | 4,3 – 46 % en volume | 15,6 W.m-1K-1 | à 0°C : 171,3 cm3/100 g eau à 40°C : 90,1 cm3/100 g eau |
Données chimiques
| pKa : H2S/HS– | pKa : HS–/S2- | E° : S(s) + 2H+ + 2e = H2S | |
| 7 | 12,9 | 0,14 V |
Produits de solubilité :
| ZnS wurtzite | pKs = 21,5 |
| ZnS blende | pKs = 23,7 |
| SnS | pKs = 25 |
| PbS | pKs = 28 |
| NiS gamma | pKs = 25,7 |
| NiS bêta | pKs = 24 |
| NiS alpha | pKs = 18,5 |
| MnS vert | pKs = 12,5 |
| MnS rose | pKs = 9,5 |
| HgS | pKs = 52,4 |
| FeS | pKs = 17,3 |
| CuS | pKs = 35,2 |
| CoS bêta | pKs = 24,6 |
| CoS alpha | pKs = 20,4 |
| CdS | pKs = 27,7 |
| Bi2S3 | pKs = 97 |
| Ag2S | pKs = 49,2 |
Données thermodynamiques
Sulfure d’hydrogène gazeux :
|
Sulfure d’hydrogène en solution aqueuse :
|
Données industrielles
Sources naturelles de sulfure d’hydrogène
Du sulfure d’hydrogène est émis par des volcans ou des sources d’eaux chaudes. Il est présent dans les gisements de pétrole et dans ceux de gaz naturel avec des teneurs variables, faibles pour le gaz russe ou algérien, élevées pour le gaz canadien ou jusqu’à 15 % pour le gaz de Lacq, en France.
Il est également formé lors de la décomposition bactérienne de matières organiques surtout en conditions anaérobies. En conséquence il est souvent présent dans des égouts, des puits, lors de la composition d’algues côtières, dans le biogaz…
Le sulfure d’hydrogène, récupéré lors de l’exploitation des gisements de gaz naturel ou obtenu par synthèse directe, est une matière première importante pour :
- La production de soufre, voir ce chapitre.
- L’industrie de production des dérivés organiques du soufre, appelée thiochimie.
Principaux composés fabriqués industriellement
Mercaptans
Méthylmercaptan (CH3SH) : principalement utilisé comme intermédiaire de synthèse de la méthionine (acide aminé utilisé dans l’alimentation des volailles, voir le chapitre sulfate de sodium) ainsi que comme matière première pour l’obtention de divers dérivés soufrés et pour la fabrication des triazines (insecticides), de carbamates d’oximes (insecticides).
Éthylmercaptan (C2H5SH) : intermédiaire de synthèse d’insecticides et d’herbicides ; utilisé comme odorisant de gaz de pétrole liquéfié (GPL).
Tertiododecylmercaptan (tC12H25SH) : agent de transfert de chaîne en polymérisation.
N-mercaptans : par exemple n-dodecyl mercaptan (C12H25SH) : utilisé comme agent de polymérisation, collecteur de flottation de minerais sulfurés et n-octyl mercaptan (C8H17SH) : utilisé comme intermédiaire de synthèse de pesticides et d’additifs pour polymères.
Sulfures aliphatiques et cycliques, polysulfures
Tétrahydrothiophène (C4H8S) : odorisant du gaz naturel dans de nombreux pays européens et en Chine.
Thiophène (C4H4S) : intermédiaire de synthèse de matières actives pharmaceutiques.
Diméthyldisulfure (CH3SSCH3) : agent sulfurant de catalyseurs et de charges de vapocraqueurs. Excellent solvant du soufre, il est utilisé pour déboucher les puits de gaz naturels sulfurés. Utilisé, en substitution au bromure de méthyle concerné par le protocole de Montréal, pour la fumigation des sols et ainsi éliminer les parasites avant plantation.
TPS, polysulfures aliphatiques : utilisés comme additifs pour lubrifiants dans le travail des métaux et dans la lubrification des engrenages.
Sulfoxydes
Diméthylsulfoxyde (CH3SOCH3) – DMSO : il est utilisé en tant que solvant aprotique polaire dans des applications variées comme les synthèses en pharmacie, les formulations et les synthèses en agrochimie, l’électronique et le décapage des peintures ainsi que des applications dans des polymères.
Acides mercapto et thiocarboxyliques
Acide thioglycolique (HSCH2COOH) et ses sels : stabilisant du PVC (sous forme de sels d’étain de l’ester), cosmétique (permanentes à froid).
Acide mercaptopropionique (HSCH2CH2COOH) : intermédiaire de synthèse.
Acide thioacétique (CH3COSH) : intermédiaire de synthèse de matières actives pharmaceutiques.
Méthylmercaptide de sodium (CH3SNa) : apporteur de méthylmercaptan sous forme liquide.
Acide méthane sulfonique (CH3SO3H) : catalyseur d’estérification, intermédiaire de synthèse, utilisé comme électrolyte dans les procédés électrolytiques de dépôts métalliques, principalement étain–plomb, en électronique.
Chlorure de méthane sulfonyle (CH3SO2Cl) : intermédiaire de synthèse de matières actives pharmaceutiques, de pesticides et de produits pour l’industrie pharmaceutique.
Méthanesulfonamide (CH3SO2NH2) : intermédiaire de synthèse de pesticides.
Mercapto2 éthanol (HOCH2CH2SH) : intermédiaire de synthèse de stabilisants pour PVC et pesticides.
Éthylthioéthanol (C2H5SCH2CH2OH) : intermédiaire de synthèse de pesticides.
Producteurs
- Arkema est le plus important producteur mondial de produits organiques soufrés. C’est, en particulier, l’un des plus importants producteurs de méthylmercaptan aux États-Unis à Houston et Beaumont, au Texas et à Mobile dans l’Alabama. En France, la production est concentrée sur le site de Lacq-Mourenx (64) à partir du sulfure d’hydrogène contenu dans le gaz de Lacq qui, extrait à faible débit, devrait continuer à approvisionner les unités de fabrication. D’autres usines sont exploitées, à Rotterdam, aux Pays Bas et à Kerteh, en Malaisie.
- Autre producteur important : Chevron Phillips Chemicals aux États-Unis et, en Belgique, à Tessenderlo.
Toxicité du sulfure d’hydrogène
Le sulfure d’hydrogène possède une odeur caractéristique d’œuf pourri qui est détectable à des teneurs inférieures à 1 ppm. En France, la valeur limite d’exposition professionnelle durant 8 h/jour est de 5 ppm soit 7 mg.m-3.
L’intoxication a lieu par la voie respiratoire et dès une teneur dans l’atmosphère de 10 ppm les premiers symptômes apparaissent avec une irritation des yeux.
- pour 100 ppm, toux, perte de l’odorat en 2 à 15 minutes,
- pour 500 à 700 ppm, perte de conscience et mort éventuelle en 30 à 60 minutes,
- pour 800 à 1000 ppm, perte de conscience rapide et arrêt cardiaque,
- > 1000 ppm, paralysie du diaphragme à la première inhalation et asphyxie rapide.
Le risque encouru avec le sulfure d’hydrogène pour des teneurs élevées, est lié à la paralysie du nerf olfactif qui supprime le principal signal d’alarme.
Bibliographie
- Documents du Syndicat National Professionnel de la Chimie Minérale, 14 rue de la République, Cedex 99, 92902 Paris la Défense.
- Documents d’Arkema, 420 rue d’Estienne d’Orves, 92705 Colombes Cedex.
- « Sulfure d’hydrogène« , fiche toxicologique n°32, INRS.
Archives
Eau
Données physico-chimiques
Données atomiques
| Formule | Masse molaire | Distance interatomique | Angle | Moment dipolaire |
| H2O | 18,015 g.mol-1 | O-H : 95,7 pm | H-O-H : 104,52° | 1,8546 D |
Données physiques
| Masse volumique | Température de fusion | Température d’ébullition | Température critique | Pression critique | Température point triple | Pression point triple | Conductibilité thermique |
|
0°C | 100°C | 374,15°C | 22,12 MPa | 0,01°C | 0,611 kPa | 0,604 W.m-1.K-1 |
Données chimiques
| pKa : H2O/HO– | E° : HO2– + H2O + 2e = 3OH– |
| 15,745 | 0,88 V |
Données thermodynamiques
Eau liquide :
|
Eau gazeuse :
|
Données industrielles
Ressources en eau
Dans le monde.
Salée : 1 350 millions de km3.
Douce : 33,6 millions de km3 dont :
- 74,4 % en neige et glace,
- 25 % en eaux souterraines,
- 0,6 % en cours d’eau et lacs,
- 0,04 % dans l’atmosphère.
Le lac Baïkal (Sibérie) de 31 500 km2 de superficie et de 1 637 m de profondeur maximale renferme 23 000 km3 d’eau douce soit environ 1/10 de l’eau douce de surface.
Ressources en eau renouvelables par habitant, pour quelques pays, en 2019 : moyenne mondiale : 5 000 m3/habitant/an, en 2014.
| Islande | 501 429 | Chine, en 2017 | 1 952 | |
| Canada | 77 571 | Allemagne | 1 844 | |
| Brésil | 40 971 | Inde | 1 398 | |
| Russie | 31 023 | Maroc | 795 | |
| Australie | 19 521 | Égypte | 573 | |
| États-Unis | 9 326 | Tunisie | 395 | |
| Japon | 3 390 | Algérie | 271 | |
| France | 3 240 | Jordanie | 93 | |
| Espagne | 2 386 | Arabie Saoudite | 70 |
Source : Aquastat
Cycle de l’eau sur terre
(en milliers de km3 par an)
Situation française : en milliards de m3 en année moyenne.
- Les précipitations moyennes sont de 512 milliards de m3/an soit 932 mm/m2. Elles s’évaporent à 61 %, alimentent les cours d’eau à 16 % et s’infiltrent dans les nappes souterraines à 23 %.
- La nappe alluviale d’Alsace est la plus importante d’Europe, surface : 2 800 km2, réserves : 50 milliards de m3 d’eau.
- Le stock d’eau dans les lacs est de 107 milliards de m3 dont 83 % correspondent à la partie française du lac Léman et 11 % aux lacs artificiels. La France possède 270 000 km de cours d’eau.
- La quantité totale d’eau douce disponible est comprise entre 3 400 et 3 800 m3/habitant/an.
Eaux en bouteilles
Consommation d’eau en bouteilles, dans le monde
En 2019. Monde : 504 629 millions de litres et 65,5 litres par habitant.
| Chine | 134 425 (138) | Brésil | 29 263 (138) | |
| États-Unis | 65 235 (199) | Thaïlande | 19 348 (279) | |
| Mexique | 44 310 (335) | Italie | 14 338 (242) | |
| Indonésie | 40 200 (150) | Allemagne | 14 296 (173) | |
| Inde | 29 517 (16) | France | 11 529 (176) |
La consommation des États-Unis était de 1,34 milliard de litres, en 1976.
Consommation d’eau en bouteilles, dans l’Union européenne
En 2019, Union européenne : 52 milliards de litres soit 118 litres par habitant.
| Italie | 200 | Grèce | 133 | |
| Allemagne | 168 | France | 133 | |
| Portugal | 140 | Belgique | 130 | |
| Hongrie | 139 | Pologne | 114 | |
| Espagne | 135 | Roumanie | 106 |
En 2016, l’eau est à 87,4 % renfermée dans du PET, 12,4 % dans du verre, 0,1 % de l’aluminium, 0,1 % du carton.
Il y a 594 sources productrices, à 82 % d’eau minérale, 16 % d’eau de source, 3 % d’eau traitée.
Commerce international de l’eau en bouteille plate et gazeuse
Principaux pays exportateurs : en 2024.
| France | 2 588 | Chine | 289 |
| Italie | 1 874 | Serbie | 146 |
| Belgique | 535 | Indonésie | 128 |
| Allemagne | 409 | Slovaquie | 125 |
| Géorgie | 306 | République tchèque | 100 |
Source : ITC
Les exportations italiennes sont destinées à 26 % à la France, 23 % les États-Unis, 10 % la Suisse, 9 % l’Allemagne.
Principaux pays importateurs : en 2024.
| Belgique | 1 097 | Suisse | 458 |
| Allemagne | 1 056 | Pays Bas | 379 |
| États-Unis | 885 | Corée du Sud | 242 |
| Royaume Uni | 592 | Chine | 175 |
| France | 552 | République tchèque | 158 |
Source : ITC
Les importations belges proviennent à 87 % de France, 5 % des Pays Bas.
Principaux producteurs d’eau embouteillée
En 2021 :
| Coca Cola (États-Unis) | 4 600 | Hangzhou Wahaha Group (Chine) | 2 800 | |
| PepsiCo (États-Unis) | 4 500 | China Resources Beverage (Chine) | 1 100 | |
| Nestlé (Suisse) | 4 170 | Ting Hsing (Taipei chinois) | 400 | |
| Danone (France) | 3 900 | Fiji Water (États-Unis) | 300 | |
| Nongfu Spring (Chine) | 3 800 | Bisleri (Inde) | 250 |
Nestlé, en 2021, a réalisé un chiffre d’affaires de 4,04 milliards de francs suisses, avec 87 unités de production dans 30 pays et 48 marques. Sa part de marché mondial est de 11 %. Le secteur de l’eau représente 4,6 % des ventes du groupe.
Danone, en 2021, a réalisé un chiffre d’affaires dans l’eau embouteillée de 3,961 milliards d’euros, soit 16 % du chiffre d’affaires du groupe. Les 3 principales marque vendues sont dans l’ordre : Aqua en Indonésie, Mizone en Chine et Évian.
Situation française
Production : en millions de litres, en 2021.
En France, les eaux minérales naturelles et de sources proviennent de gisements souterrains bénéficiant d’une protection géologique naturelle et ne subissent aucun traitement de désinfection. L’eau minérale naturelle a pour obligation d’avoir une composition minérale stable, garantie tout au long de l’année. Elle peut présenter une minéralité particulière qui lui confèrent des propriétés bénéfiques. L’eau de source n’a pas l’obligation de garantir une composition minérale stable. La France est l’un des rares pays où s’est développée la consommation d’eau de source.
- Production d’eaux minérales naturelles : 6 434 (2 900 en 1980).
- Production d’eaux de sources : 4 874.
- La production est à 83 % plate et 17 % gazeuse.
Il y a 78 sources exploitées d’eaux minérales, 74 d’eaux de source et 6 eaux rendues potables par traitement.
Cartes française des sources d’eaux minérales, document de la Maison des Eaux Minérales Naturelles.

Commerce extérieur : en millions de litres, en 2024.
Eaux minérales naturelles plates :
- Exportations : 2 160 vers l’Allemagne à 37 %, la Belgique à 24 %, le Royaume Uni à 13 %, la Suisse à 8 %.
- Importations : 273 d’Italie à 84 %, de Belgique à 5 %, du Luxembourg à 5 %.
Eaux minérales naturelles gazeuses :
- Exportations : 252 vers la Belgique à 31 %, l’Allemagne à 12 %, le Canada à 9 %, les États-Unis à 7 %, la Chine à 7 %.
- Importations : 259 d’Italie à 93 %, de Belgique à 2 %.
Eaux artificielles :
- Exportations : 165 vers les États-Unis à 56 %, l’Allemagne à la 36 %, Belgique à 5 %.
- Importations : 22 du Luxembourg à 86 %, d’Italie à 9 %.
Répartition des ventes d’eaux plates, en volume, en grandes et moyennes surfaces, en 2016 :
| Cristaline (Alma) | 34,5 % | Volvic (Danone) | 7,1 % | |
| Vittel (Nestlé) | 8,5 % | Contrex (Nestlé) | 6,3 % | |
| Evian (Danone) | 7,9 % | Hépar (Nestlé) | 4,2 % |
Source : Rayon Boissons
Répartition des ventes d’eaux gazeuses, en volume, en grandes et moyennes surfaces, en 2014-15 :
| Perrier (Nestlé) | 21 % | St Yorre (Alma) | 5 % | |
| Salvetat (Danone) | 17 % | Vichy Célestins (Alma) | 3 % | |
| Badoit (Danone) | 15 % | Rozana (Alma) | 3 % | |
| San Pellegrino (Nestlé) | 9 % | Cristalline (Alma) | 2 % | |
| Quézac (Nestlé) | 7 % | Vernière (Alma) | 1 % |
Source : Rayon Boissons
Principaux producteurs d’eaux minérales :
- Alma vente de 4 milliards de bouteilles avec les marques St Yorre, Vichy Célestin, Vernière, Thonon, Cristaline, Courmayeur, Rozana… L’eau de source Cristaline exploite 22 sources.
- Nestlé, avec les marques Contrexéville, Vittel, Perrier, Hépar, Valvert, Aquarel, Quézac, San Pellegrino … Possède, en France, 32,4 % de part de marché.
- Danone, avec les marques internationales : Evian, Volvic, Bonafont (Mexique, Brésil, Pologne), Mizone (Chine, Indonésie) et locales : Fontvella et Lanjarón (Espagne), Villavicencio et Villa del Sur (Argentine), Aqua (Indonésie), Zywiec Zdroj (Pologne).
Traitements de l’eau en vue de la rendre potable
On estime, en 2015, que dans le monde, 844 millions de personnes n’ont pas accès à l’eau potable soit 263 millions qui ont un accès à plus de 30 minutes aller-retour, 423 millions qui prélèvent l’eau dans des puits ou des sources non protégés et 159 millions qui prélèvent de l’eau de surface et près de 2,3 milliards n’ont pas accès à des services d’assainissement adéquats.
Dessalement de l’eau de mer et des eaux saumâtres
Début 2022, il y a 22 757 usines de dessalement en fonctionnement avec une capacité de production de 107,95 millions de m3/jour.
Vidéo de présentation par Veolia.
Origine de l’eau dessalée, en 2015, sur un total de 86,5 millions de m3/jour.
| Eaux de mer | 59 % | Eaux de rivière | 9 % | |
| Eaux saumâtres | 22 % | Eaux usées | 5 % |
Source : Water World
Capacités de production, selon le procédé utilisé, en 2014, en % :
| Osmose inverse | 65 % | Distillation multiples effets | 7 % | |
| Distillation flash | 21 % | Électrodialyse et électrodésionisation | 3 % |
Source : IDA
En 2016, les procédés membranaires représentent 73 % des capacités de production, les procédés thermiques, 27 %.
Traditionnellement, l’eau de mer (35 à 50 g de sel/L) était plutôt distillée, alors que les eaux saumâtres (1 à 10 g/L) étaient traitées par osmose inverse. Actuellement, pour l’eau de mer, l’osmose inverse, consommant moins d’énergie, est de plus en plus utilisée. Par osmose inverse, 8 litres d’eau de mer donnent 4 litres d’eau douce et le même volume d’eau deux fois plus concentrée en sel.
Utilisé principalement dans les pays désertiques de la péninsule arabique : 70 % des besoins en eau pour la consommation humaine en Arabie Saoudite provient de 31 usines de dessalement d’eau de mer qui fournissent 1,2 milliard de m3/an, principalement par distillation.
Capacités de production, dans le monde, des usines de dessalement, en 2014 :
| Arabie Saoudite, en 2016 | 6,6 | Algérie | 2,2 | |
| Émirats Arabes Unis | 4,1 | Australie | 1,7 | |
| Espagne | 3,3 | Israël | 1,4 | |
| États-Unis | 2,9 | Inde | 1,1 | |
| Chine | 2,4 | Qatar | 1,0 |
Source : Desaldata.com
Veolia est le premier producteur mondial avec, en 2019, une capacité de production de 13 millions de m3/jour, sur 2 300 sites dans 108 pays.
En Arabie Saoudite, la société d’état Saline Water Conversion Corporation, exploite 28 usines de dessalement avec une capacité de production de 4,6 millions de m3/jour, soit 69 % de la capacité du pays. En 2018, la production a été de 1 803 millions de m3.
La principale usine mondiale est celle de Ras Al Khair, en Arabie Saoudite. Sa capacité de production est de 1,025 million de m3/jour, à 70 % par distillation thermique à l’aide de 8 unités flash et 30 % par osmose inverse à l’aide de 17 unités.
En 2016, la plus importante usine au monde fonctionnant seulement par distillation thermique est celle de Shoaiba, en Arabie Saoudite, avec une capacité de production de 880 000 m3/jour.
L’une des plus importantes usines dans le monde fonctionnant par osmose inverse (320 000 m3/jour permettant d’alimenter 1,4 million de personnes) a été construite par Veolia à Ashkelon en Israël. 2 lignes de production fonctionnant en parallèle permettent après passage dans 32 unités d’osmose inverse de diminuer la concentration en sel de 45 g/L à 30 mg/L, la concentration maximale admissible pour la consommation humaine étant de 400 mg/L. En 2016, la plus importante usine dans le monde fonctionnant par osmose inverse est celle de Sorek, en Israël, au sud de Tel Aviv, avec une capacité de production de 627 000 m3/jour.
Traitements classiques d’une eau de rivière
Exemple de l’usine de traitement de Morsang-sur-Seine qui produit 225 000 m3/jour dans 3 unités en parallèle (voir schéma ci-dessous). La plus importante station de traitement d’eau potable en France est celle de Choisy-le-Roi : capacité de production maximale : 600 000 m3/jour, production moyenne : 313 000 m3 par jour.
Usine de traitement de l’eau de la Seine de Morsang-sur-Seine
(d’après un document de la Lyonnaise des Eaux que nous remercions)
Prélèvement d’eau brute de Seine avec élimination des particules de taille supérieure à 1 mm par prise d’eau sous la surface, dégrillage puis tamisage.
Prétraitement : la tendance actuelle est d’éviter la préchloration afin de ne pas former des composés du chlore avec l’ammoniac (chloramine donnant un goût désagréable) et avec des produits organiques (chlorophénols, chlorobenzènes, trichlorométhanes…), certains de ces composés étant toxiques ou suspects d’être cancérigènes. Il est préférable d’effectuer la chloration après élimination de l’ammoniac et des matières organiques.
Coagulation-floculation-décantation : le problème à résoudre est celui des particules de taille inférieure à quelques μm, chargées négativement, qui sont en suspension stable et qu’il faut éliminer.
- La coagulation permet la neutralisation des charges négatives à l’aide d’ions Al3+ (apportés par une solution de Al2(SO4)3 ou de polychlorures d’aluminium) qui précipitent sous forme d’hydroxyde d’aluminium Al(OH)3 à la surface des particules. L’apport est de 3 à 17 g Al2O3/m3. Les sels de fer (sous produits de l’industrie du dioxyde de titane) sont également employés. Les coagulants minéraux sont concurrencés par des coagulants organiques tels que le polymère de chlorure de diallydiméthyl ammonium (poly DADMAC).
- La floculation se traduit par le grossissement des particules par agglomération à l’aide d’un polymère (polyacrylamide anionique).
- Lors de la décantation, l’eau traverse par percolation une masse de boue constituée par les particules déjà séparées.
Traitements complémentaires :
- Une filtration sur sable permet l’élimination des derniers flocs à travers 1 m d’épaisseur de sable, avec une vitesse de filtration de 13 m/h.
- Ozonation : l’ozone est le désinfectant le plus efficace (voir le chapitre eau de Javel), avec 0,4 mg/L d’ozone résiduel et une durée de contact avec l’eau de 10 minutes. De façon générale, l’ozone est obtenu par décharge électrique à la fréquence de 800 Hz dans le dioxygène ou l’air (ou un mélange des deux) entre des tubes concentriques séparés de 1 à 2 mm qui constituent les électrodes. Le tube extérieur est en acier inoxydable, le tube intérieur est en verre (qui sert de diélectrique) métallisé. Un ozoneur contient quelques centaines de tubes. Le refroidissement est assuré par un courant d’eau. Les capacités de production peuvent atteindre plus de 150 kg de O3/h et la concentration en O3 atteindre 10 % dans le dioxygène. La consommation d’énergie varie, pour une tonne d’ozone, de 2 kWh dans l’air à 8 kWh dans le dioxygène.
- Une filtration sur charbon actif dégrade biologiquement les matières organiques dissoutes et permet l’élimination des goûts, pesticides, hydrocarbures, détergents avec une épaisseur de 1,30 m, à une vitesse, selon la filière, de 7 à 10 volumes d’eau traversant 1 volume de charbon en 1 h.
- Une désinfection finale est effectuée à l’aide de Cl2 ou d’eau de Javel. Le Cl2 résiduel doit avoir une teneur de 0,10 mg/L au robinet du consommateur.
- Une correction de pH est réalisée à l’aide d’une solution de NaOH ou de H2SO4 pour éviter les problèmes liés au CO2 dissous dans l’eau et obtenir ainsi une eau ni agressive, ni incrustante.
Contrôle de la qualité de l’eau traitée :
- Une station d’analyse en continu et d’alerte est située à Nandy, à 5 km en amont de la prise d’eau avec suivi en continu de 18 paramètres : pH, résistivité, température, turbidité, dioxygène dissous, NH3, radioactivité bêta, C.O.T., hydrocarbures, absorption UV à 254 nm, 6 métaux lourds, toxicité globale par test poisson (ichtyotest).
- Un contrôle en continu de la turbidité, du pH, de la dose de réactifs, de l’ozone et du dichlore résiduels, est réalisé.
- Une analyse quotidienne à chaque étape du traitement et au refoulement est effectuée.
Traitement des eaux à l’aide de membranes
Par ultrafiltration (avec des pores de 3 à 10 nm) ou par nanofiltration (avec des pores d’environ 1 nm). Ces techniques utilisent le pouvoir de tamisage des membranes. Jusqu’à présent réservées au traitement d’eaux souterraines, elles commencent à être utilisées pour le traitement d’eaux de surface :
Par ultrafiltration, par exemple, par la Lyonnaise des Eaux, à Anglet (64), 5 000 m3/jour, pour traiter les eaux de la Nive. Les modules de filtration contiennent de l’ordre de 15 000 fibres creuses soit par module, 50 m² de surface filtrante. Le procédé CRISTAL® (Combinaison des Réacteurs Incluant Séparation par membranes Traitement par Adsorption en voie Liquide) mis au point par Degrémont, après une préfiltration à 200 μm, associe un traitement sur charbon actif en poudre à l’ultrafiltration tangentielle qui, à l’usine de Vigneux-sur-Seine de La Lyonnaise des Eaux, représente 1,2 hectare de surface filtrante. Comparé à l’ozonation, ce procédé est plus efficace vis à vis des composés organiques insaturés, des triazines, des mauvais goûts et des odeurs. En effet, en période chaude, l’ozonation n’élimine pas toujours complètement les goûts et les odeurs.
Rendements d’élimination (en %) de divers polluants lors du traitement de l’eau à l’usine de Vigneux-sur-Seine :
| Décantation | Filtration sur charbon | Ozone | CRISTAL® | |
| Particules | 85 | 95 | – | 100 |
| Bactéries | 90 | 99 | 99,9 | 100 |
| Virus | 90 | – | 99,9 | 100 |
| Organismes parasites (protozoaires) | 99 | – | 99,9 | 100 |
| Algues, plancton | 99 | – | 99,9 | 100 |
| Micropolluants organiques (pesticides) | – | 10 | 99,9 | 100 |
| Matières organiques dissoutes | 50 | 60 | – | 90 |
| Métabolites d’algues (responsables des goûts et des odeurs) | – | 10 | 60 | 100 |
Source : Lyonnaise des Eaux
Par nanofiltration, par exemple, par le Syndicat des Eaux de l’Île de France (SEDIF), à Méry-sur-Oise (95), qui recourt à cette filière de traitement pour 70 % de sa production, les 30 % restants provenant de sa filière classique de traitement biologique (ozone-charbon actif). L’usine de Méry-sur-Oise, à partir de l’eau prélevée dans l’Oise, alimente 850 000 habitants avec une production moyenne de 152 000 m3 par jour. L’eau à traiter, après une étape de clarification poussée, passe encore par des pré-filtres qui retiennent les particules supérieures à 6 µm avant de traverser les membranes de nanofiltration qui retiennent les particules supérieures à 1 nanomètre. Par filtration tangentielle, sous l’effet d’une différence de pression entre les deux faces de la membrane, une partie du débit traverse la membrane en abandonnant la plupart des composés contenus. L’autre partie, ne traversant pas la membrane, se charge des composés retenus. L’eau est ainsi purifiée, physiquement, des micro-organismes, produits organiques, pesticides contenus et ne nécessite, par sécurité, qu’un apport réduit de dichlore lors de sa distribution (0,2 mg.L-1) soit une réduction d’un facteur 10 de la quantité totale de chlore utilisé. Par ailleurs, le procédé permet d’adoucir l’eau.
Distribution de l’eau potable
En France, en 2016, les prélèvements d’eau destinés à la production d’eau potable ont été de 5,425 milliards de m3, avec 20,7 % de fuites dans les canalisations, en 2014. L’eau provenait à 65,1 % d’eaux souterraines et à 34,9 % d’eaux de surface avec, en 2015, un total de 33 150 captages.
Le réseau de canalisations de distribution a, en 2013, une longueur de 996 000 km.
A Paris : la production, gérée par Eau de Paris, est, en 2021, en moyenne de 468 493 m3/jour d’eau potable et 200 000 m3/jour d’eau non potable, avec une capacité de production de 1 million de m3/jour et une capacité de stockage de deux jours de consommation avec un réseau de distribution de 2 455 km d’eau potable et 1 700 km d’eau non potable. En 2021, la production d’eau potable a été de 170,9 millions de m3.
En 2021, 53 % de la production d’eau potable provient de 102 points de captages d’eaux souterraines situés dans les régions de Provins (77), Sens (89), Fontainebleau (77) et Dreux (28), amenées à l’aide de 4 aqueducs principaux (la Vanne pour 27 %, le Loing pour 15 %, la Voulzie et l’Avre pour 11 %) de 470 km de longueur. La source la plus éloignée (156 km) est située à Armentières (10). L’eau est stockée dans 5 réservoirs (Montsouris, Les Lilas et Ménilmontant, dans Paris ainsi que Saint-Cloud (92) et l’Haÿ les Roses (94)) et traitée dans 5 usines (Sorques (77), Longueville (77), Saint-Cloud (92), Porte d’arcueil (75) et l’Haÿ les Roses (94)).
47 % de la production d’eau potable provient d’eau de surface de la Seine (26 %) et de la Marne (21 %) traitée à Orly (300 000 m3/j) et Joinville (210 000 m3/j).
En Île de France : le Syndicat des Eaux d’Île de France (SEDIF), est le 1er distributeur d’eau en France et le 3ème en Europe. La gestion du réseau est déléguée, depuis le 1er janvier 2011 et pour 12 ans, à Veolia. Le SEDIF alimente, en 2021, 135 communes et 4,02 millions d’habitants. Les capacités de production sont de 1,54 million de m3/jour pour une consommation moyenne de 762 000 m3/jour. 97 % des ressources du Syndicat des Eaux d’Île de France proviennent des trois grandes rivières ou fleuve de la région : Marne, Seine, Oise, 3 % de forages dans les nappes (à Neuilly-sur-Seine, Pantin, Aulnay-sous-Bois et Arvigny). La consommation d’eau des abonnés a été, en 2021, de 209,65 millions de m3.
En 2021, l’usine de Choisy-le-Roi alimente 1,92 million d’habitants avec une production moyenne, de 302 000 m3 par jour ; l’usine de Méry-sur-Oise alimente 880 000 habitants avec une production moyenne de 134 000 m3 par jour ; l’usine de Neuilly sur Marne alimente 1,77 million d’habitants avec une production moyenne de 325 000 m3 par jour. Le réseau de canalisations est de 7 929 km et 76 réservoirs ont une capacité de 848 595 m3.
En France, en 2017, le volume d’eau distribué, pour 24,2 millions d’abonnés, a été de 3,9 milliards de m3, à 64 % par le secteur privé et celui du traitement des eaux usées a été de 3,1 milliards de m3, à 53 % par le secteur privé.
Sociétés distribuant l’eau potable en France : répartition du marché, en % de population desservie, en 2017.
| Alimentation en eau potable | Stations d’assainissement | |
| Opérateurs publics | 35,3 % | 46,0 % |
| Veolia eau | 33,7 % | 22,9 % |
| Suez | 18,6 % | 21,4 % |
| SAUR | 11,4 % | 9,0 % |
| Autres | 0,9 % | 0,6 % |
Principaux distributeurs mondiaux :
Les entreprises françaises, en 2017, ont desservi, dans le monde hors France, 128,54 millions de personnes en eau potable et 112,38 millions en assainissement des eaux usées.
Veolia : en 2021. N°1 mondial.
Dans le monde, 79 millions d’habitants desservis en eau potable avec 3 367 usines et 61 millions en assainissement avec 2 750 usines.
En France, fourniture d’eau potable à 25,5 millions d’habitants et assainissement pour 17,1 millions d’habitants.
Début 2022 a acquis le groupe Suez.
Beijing Enterprise Holdings, groupe chinois, possède, en 2021, une capacité de production de 45,38 millions de m3/jour avec 1 412 usines de production.
Suez : en 2022. N°3 mondial.
Après l’acquisition par Veolia, livraison, par le nouveau groupe Suez, d’eau potable dans le monde à 66 millions de personnes et assainissement pour 33,7 millions de personnes. L’activité eau en France est gardée par le nouveau Suez.
En France, en 2019, fourniture de 935 millions de m3 d’eau potable avec 702 sites et traitement de 820 millions de m3 d’eaux usées avec 1 642 stations d’épuration.
Utilisations
Il faut distinguer les prélèvements des consommations.
- Les prélèvements utilisent et restituent l’eau directement par exemple pour l’eau de refroidissement des centrales thermiques, nucléaires et autres, qui est, à 90 %, restituée directement.
- Les consommations absorbent l’eau qui n’est pas ainsi restituée directement par exemple pour l’irrigation.
Prélèvements d’eau : en 2011. Monde : 3 890 km3, Union européenne : 218 km3.
| Chine | 525 | Pakistan | 155 | |
| Inde | 500 | Russie | 77 | |
| États-Unis | 467 |
Secteurs d’utilisation dans le monde, en 2012 :
| Irrigation | 70 % | Usages domestiques | 10 % | |
| Industrie | 20 % |
Répartition des prélèvements d’eau par secteur d’activité, en France, en 2018, hors énergie, sur un total de 16,8 milliards de m3 prélevés :
| Eau potable | 33,4 % | Irrigation | 18,0 % | |
| Alimentation des canaux | 32,3 % | Industrie | 16,3 % |
Les prélèvements, en France, hors énergie, en 2018, sont réalisés à 63,7 % sur des eaux de surface, 35,1 % sur les eaux souterraines, 1,2 % sur le littoral.
En 2018, en France métropolitaine, les prélèvements pour l’alimentation en eau potable sont de 5 422 millions de m3, à 65,2 % d’eau souterraine, 34,6 % d’eau de surface et 0,2 % sur le littoral.
En 2018, en France métropolitaine, les prélèvements pour l’irrigation sont de 3 024 millions de m3 à 58,8 % d’eau de surface et 41,2 % d’eau souterraine.
Les prélèvements les plus importants sont réalisés par le site du Tricastin et ses centrales nucléaires, avec 5 milliards de m3 par an.
Usages domestiques de l’eau potable
Quelques données :
- Besoins moyens de l’homme : 35 g d’eau/kg/jour, son corps contient de 58 à 66 % d’eau et il meurt s’il perd 12 % de son eau.
- Prélèvements d’eau pour les usages domestiques dans quelques pays, en 2016 :
| États-Unis | 551 | Espagne | 268 | |
| Canada | 471 | France | 211 | |
| Australie | 462 | Allemagne | 172 | |
| Japon | 328 | Chine | 152 | |
| Suisse | 319 | Inde | 125 |
Source : Centre d’Information sur l’Eau
- Carte des prélèvements d’eau destinée à l’eau potable, en France, d’après le rapport sur l’environnement.
- Utilisations domestiques de l’eau potable en France, sur une consommation, en 2008, de 151 L/jour/habitant (146 L/jour/habitant, en 2016).
| Bains, douches, toilettes | 39 % | Lavage voiture, jardin | 6 % | |
| Sanitaires | 20 % | Cuisine | 6 % | |
| Lavage linge | 12 % | Boisson | 1 % | |
| Lavage vaisselle | 10 % |
Usages industriels
Répartition, en France, en 2013 :
| Chimie | 28,9 % | Papiers et cartons | 7,4 % | |
| Distribution du gaz et de la chaleur | 9,4 % | Métallurgie | 4,1 % | |
| Traitement et récupération des déchets | 7,7 % | Extraction des minéraux | 3,4 % | |
| Agroalimentaire | 7,5 % | Fabrication de produits minéraux | 1,5 % |
Source : « Les prélèvements d’eau douce en France« , DataLab, SOes, janvier 2017
Utilisation dans les centrales électriques
Comme source d’énergie dans les centrales hydro-électriques et comme source froide dans le cycle thermodynamique des centrales thermiques classiques et nucléaires. Une centrale nucléaire a besoin de 40 à 50 m3 par seconde.
Source d’énergie hydroélectrique : en France en 2018. Première filière de production d’énergie renouvelable en France, l’hydroélectricité représente 13 % de la production d’électricité avec 1 860 installations. La puissance installée est de 25 519 MW soit 55 % des énergies renouvelables. Les lacs représentent 40 % des capacités installées, le fil de l’eau 26 %, le pompage (STEP) 18 %, les éclusées 16 %.
Production : 70 TWh d’origine hydroélectrique (sur une production totale de 558 TWh), réalisée à 70 % dans les Alpes, 20 % dans le Massif central, 10 % les Pyrénées. 1 935 centrales hydroélectriques de moins de 10 MW représentent une production de 6,9 TWh en 2010.
Exploitants des installations hydroélectriques :
- EDF avec, en 2019, 20 548 MW de puissance installée pour une production de 39,7 TWh avec 622 barrages et 432 centrales. Le volume d’eau stocké dans les barrages est de 7,5 milliards de m3.
- Engie avec :
La Compagnie Nationale du Rhône (CNR, détenue à 49,97 %) avec 3 035 MW de puissance installée pour une production de 14,3 TWh avec 19 barrages et 36 centrales hydroélectriques.
La Société Hydro-Electrique du Midi (SHEM) avec 783 MW de puissance installée pour une production de 1,8 TWh avec 12 grands barrages et 56 centrales.
Source de refroidissement des centrales thermiques : en circuit ouvert ou en circuit fermé.
- En circuit ouvert, l’eau extérieure (de mer ou de rivière) est prélevée et rejetée en continu. Pour un réacteur nucléaire de 900 MW, le débit d’eau est de 41 m3/s, l’échauffement de l’eau de 10,8°C. Par kWh de production, le volume prélevé est de 164 L et l’évaporation de 1,55 L.
- En circuit fermé, l’eau après utilisation est refroidie dans des réfrigérants atmosphériques puis recyclée. La chaleur est évacuée à 20 % par échauffement de l’air et à 80 % sous forme de chaleur latente d’évaporation. Un débit d’appoint reste nécessaire, il est de 0,3 à 8 m3/s. Pour une centrale nucléaire de 900 MW, le prélèvement moyen est de 3 L/kWh, l’évaporation de 2,1 L/kWh.
Usage agricole
L’agriculture mondiale irrigue 310 millions d’hectares sur un total de 1,5 milliard de terres cultivées. En France, de 1970 à 2010, la surface irriguée est passée de 539 000 ha à 1,6 million d’hectares sur un total de 29,2 millions d’hectares.
Répartition des cultures irriguées, en France, en 2010 :
| Maïs | 41 % | Cultures fourragères | 11 % | |
| Céréales et protéagineux | 24 % | Pommes de terre et betteraves | 7 % | |
| Légumes, fruits, vignes | 15 % |
La production d’un kg de blé nécessite 1 000 L d’eau, celle d’un kg de bœuf : 13 000 L.
Pollution de l’eau
L’eau est rarement chimiquement pure. Celle-ci est définie par rapport à la résistivité théorique de l’eau ultra pure : 18,2 mégaohm.cm à 25°C. A part ce cas exceptionnel, l’eau contient toujours des ions en solution. On parle de pollution de l’eau lorsque celle-ci renferme des substances dont les teneurs sont telles que cette eau présente des risques pour la santé ou l’environnement.
4 des 5 maladies les plus répandues dans le Tiers Monde sont transmises par l’eau : le choléra, la typhoïde, l’hépatite B, les gastro-entérites. Dans le monde, on estime que la mauvaise qualité de l’eau serait à l’origine de la mort de 25 millions de personnes par an. Chaque jour, dans le monde, 3 900 enfants meurent de maladies transmises par l’eau.
Types de pollution générale : on distingue la pollution due aux :
- Microorganismes pathogènes : bactéries, virus, parasites…
- Matières minérales en suspension (MES) : sables, argiles, faciles à traiter et éliminer. En France, les teneurs varient de 30 à 40 mg/L pour les eaux de surface d’une région granitique (Auvergne, Bretagne), à 300 à 500 mg/L pour de nombreuses eaux souterraines. Le taux record est atteint, en Chine, par le Fleuve jaune : 20 g/L.
- Matières organiques oxydables : provenant de la nature, de l’agriculture, des industries, des déchets animaux et humains… Les substances organiques naturelles représentent 60 à 90 % de ces matières organiques. Cette pollution est mesurée par la potentialité de consommation de dioxygène. Une eau « pure » contient 10 mg de O2/L à 10°C et 8 mg/L à 20°C. Dans une eau polluée par des matières organiques, la teneur en dioxygène sera plus faible. On utilise pour mesurer cette pollution :
La D.B.O5 : demande biochimique en O2 à 20°C en 5 jours, soit la quantité de O2 consommée à 20°C en 5 jours : méthode longue et peu précise.
La D.C.O. : demande chimique en O2. D’après la norme française NF T 90-101 d’octobre 1988 (équivalente à la norme internationale ISO 6060 de 1986), c’est la concentration, exprimée en mg de O2/L, équivalente à la quantité d’ions dichromate consommée par les matières dissoutes et en suspension (1 mole de Cr2O72- équivaut à 1,5 mole de O2) - Ions en solution à des teneurs trop élevées : nitrates, phosphates, métaux…
- Matières toxiques : souvent due à des causes accidentelles. Cette pollution impose la présence de stations d’alerte situées en amont des prélèvements dans les rivières.
Qualité des eaux : jusqu’en 1999, la qualité des cours d’eau était évaluée, en France, à partir d’une grille qui associait 5 classes de qualité (1A, 1B, 2, 3, hors classe) en fonction de valeurs seuils des paramètres physico-chimiques et hydrobiologiques. Depuis le 1er janvier 2000, le SEQ-Eau (Système d’Évaluation de la Qualité de l’Eau) remplace l’ancien système d’évaluation. La qualité de l’eau est décrite pour chacune des altérations (matières organiques et oxydables, matières azotées, nitrates, matières phosphorées, particules en suspension, micro-organismes…) à l’aide :
- De 5 classes de qualité allant du bleu pour la meilleure, au rouge pour la pire,
- D’un indice variant en continu de 0 (le pire) à 100 (le meilleur).
L’indice de qualité permet de juger de l’évolution de la qualité de l’eau à l’intérieur d’une même classe. C’est donc une évaluation beaucoup plus précise que celle utilisée auparavant.
| Classe | Indice de qualité | Définition de la classe de qualité |
| Bleu | 80 à 100 | Eau de très bonne qualité |
| Vert | 60 à 79 | Eau de bonne qualité |
| Jaune | 40 à 59 | Eau de qualité moyenne |
| Orange | 20 à 39 | Eau de mauvaise qualité |
| Rouge | 0 à 19 | Eau de très mauvaise qualité |
Classes d’aptitudes de l’eau :
| Très bonne | Bonne | Passable | Mauvaise | Très mauvaise | |
| Biologie | Tous taxons présents | Taxons sensibles absents | Taxons absents nombreux | Diversité faible | Diversité très faible |
| Eau potable | Acceptable | Traitement simple | Traitement classique | Traitement complexe | Inapte |
| Loisirs | Optimal | – | Acceptable | – | Inapte |
| Irrigation | Plantes très sensibles/tous sols | Plantes sensibles/tous sols | Plantes tolérantes/sols alcalins et neutres | Plantes très tolérantes/sols alcalins et neutres | Inapte |
| Abreuvage | Tous animaux | – | Animaux matures | – | Inapte |
Classes de qualité pour 3 altérations :
| Classe de qualité | Bleu | Vert | Jaune | Orange | Rouge |
| Indice de qualité | 100-80 | 79-60 | 59-40 | 39-20 | 19-0 |
| Oxygène dissous (mg/L) | 8 | 6 | 4 | 3 | – |
| DBO5 (mg/L O2) | 3 | 6 | 10 | 25 | – |
| DCO (mg/L) | 20 | 30 | 40 | 80 | – |
| KMnO4 (mg/L O2) | 3 | 5 | 8 | 10 | – |
| COD (mg/L C) | 5 | 7 | 10 | 12 | – |
| NH4+ (mg/L NH4) | 0,5 | 1,5 | 2,8 | 4 | – |
| NKJ (mg/L N) | 1 | 2 | 4 | 6 | – |
| NO3– (mg/L NO3) | 2 | 10 | 25 | 50 | |
| Phosphore total (mg/L) | 0,05 | 0,2 | 0,5 | 1 | – |
| PO43- (mg/L PO4) | 0,1 | 0,5 | 1 | 2 | – |
Normes françaises pour l’eau potable :
Les exigences de qualité en vigueur en France sont fixées par arrêté du Ministère de la Santé (arrêté du 11 janvier 2007 relatif aux limites et références de qualité des eaux brutes et des eaux destinées à la consommation humaine mentionnées aux articles R. 1321-2, R. 1321-3, R. 1321-7, R. 1321-38 du code de la santé publique). Elles ont été établies en application de la réglementation européenne (directive 98/83/CE) et complétées à la demande du CSHPF (Conseil Supérieur d’Hygiène Publique) et de l’Afssa (Agence Française de Sécurité Sanitaire).
Pollution par les ions nitrates : due, en dehors des phénomènes naturels, principalement au lessivage des engrais azotés utilisés en agriculture et aux déjections animales (lisier) des élevages industriels.
En 2010-11, en France, les apports d’azote proviennent, sur un total de 4,46 millions de t d’azote, à :
- 46 % des engrais minéraux,
- 39 % des effluents d’élevage,
- 8 % de l’azote capté par les légumineuses,
- 7 % des retombées d’azote atmosphérique.
Seuls 3,19 millions de t ont été assimilés par les cultures, 0,61 million de t étant perdus par volatilisation dans l’atmosphère.
Il reste donc un surplus de 0,66 million de t qui est évacué par les eaux de surface ou qui s’infiltre dans les eaux souterraines.
Carte de France des surplus de la fertilisation azotée, en 2010, source : SOeS, 2013 :
La concentration maximale admissible (CMA) en ions nitrates des eaux destinées à la consommation humaine est de 50 mg/L. Une eau contenant plus de 100 mg/L ne doit pas être consommée, entre 50 et 100 mg/L elle ne doit être consommée ni par les femmes enceintes ni par les nourrissons de moins de 6 mois (risques de méthémoglobinémie : accumulation dans les globules rouges d’une hémoglobine inapte au transport du dioxygène de l’air). La CMA est dépassée dans de nombreuses régions européennes (Royaume-Uni, Pays-Bas, Allemagne, centre, ouest et nord de la France).
La solution souvent adoptée pour diminuer la teneur en ions nitrate des eaux consommées consiste à mélanger des eaux à teneur élevée avec des eaux à plus faible teneur afin de rester à une valeur proche de 25 mg/L (valeur guide).
En France, des zones vulnérables à la pollution par les ions nitrate ont été définies en application de la directive nitrate CE/91/676 du 12 décembre 1991. Elles sont représentées, pour 2012, sur la carte ci-dessous.
Pollution par les ions nitrate, en France
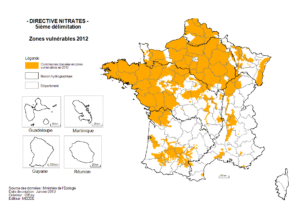
Données sur la pollution en nitrates des eaux de surface et souterraines françaises, en 2016-17, à l’aide d’un réseau de 5 494 stations (55 % de surface, 45 % souterraines) : répartition.
| X : teneur en nitrates en mg/L |
Eaux de surface | Eaux souterraines | |
| X < 25 | 84,9 % | 50,2 % | |
| 25 < X <40 | 12,1 % | 25,4 % | |
| 40 < X < 50 | 1,9 % | 12,1 % | |
| X > 50 | 1,1 % | 12,3 % |
Source : Office International de l’eau
Concentration moyenne en nitrates dans les eaux souterraines entre 2015 et 2017 et tendance d’évolution entre 1996 et 2016, d’après Eaufrance, Prélèvement quantitatif sur la ressource en eau.
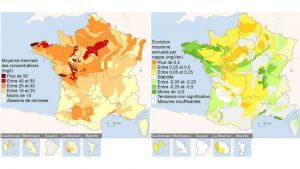
Pollution par les ions phosphates : les ions phosphate, avec l’azote, agissent comme engrais et entraînent l’eutrophisation des lacs, des rivières et des zones côtières qui se traduit par une prolifération anormale d’algues (cyanophycées). L’eau est appauvrie en O2 dissous ce qui empêche toute autre vie animale ou végétale.
L’utilisation des phosphates dans les détergents domestiques pour textiles est interdite, en France, depuis le 1er juillet 2007, mais ceux-ci continuent à être employés dans les détergents industriels pour textiles et les détergents pour lave-vaisselle. Un directive européenne limite, au plus tard au 1er janvier 2017, à 0,3 g de P par dose de lavage pour les lave-vaisselles des particuliers.
Avant leur interdiction, la quantité utilisée, en France était de 20 000 t/an pour les détergents domestiques pour textiles, elle est du même ordre pour les détergents industriels et pour lave-vaisselle.
Surplus de la fertilisation phosphatée, en 2010 : le surplus est de 268 000 t de phosphore soit 9 kg/ha. Il représente 22 % de la fertilisation phosphatée.
Exemple du lac Léman d’une superficie de 582,4 km2, avec une profondeur moyenne de 152,7 m, un volume d’eau de 89 milliards de m3 et un temps de séjour des eaux de 11,3 ans. Il assure l’alimentation en eau potable de plus de 800 000 personnes.
- En 1960 a été créée la Commission Internationale pour la Protection des Eaux du Léman (CIPEL)
- En 1967 a été détectée l’apparition d’algues brunes Oscillatoria rubescens.
- En 1975, début de la mise en place de la déphosphatation dans les stations d’épuration des eaux usées.
- Actuellement, 95 % des eaux usées traitées en station sont déphosphatées. Le rendement de déphosphatation est, en moyenne, de 88 %, en 2018. En 1986, suppression, en Suisse, des phosphates dans les lessives pour textiles ce qui a permis de réduire chaque année d’environ de moitié les apports de phosphore au lac. En France, cette interdiction date de juillet 2007.
Évolution de la teneur en phosphore (en μg de P/L) : avant 1960 : 10, en 1979 (maximum) : 90, en 1992 : 50, en 2003 : 33, en 2018 : 19,9. L’objectif visé est une concentration inférieure à 15 µg/L.
Bilan, en 2017, des rejets de phosphore biodisponible dans le lac Léman, sur un total de 283 t de P/an :
| Rejets des stations d’épuration | 94 | Dépôts naturels | 130 | |
| Rejets domestiques non raccordés ou autonomes | 11 | Rejets agricoles | 35 | |
| Déversements de réseaux | 9 | Pluies | 4 |
Dans les bassins versants du lac Léman, le flux total de phosphore biodisponible issu des activités industrielles et domestiques est, en 2017, de 812 t de P, les stations d’épuration en retiennent 714 t.
Pollution par les pesticides (herbicides, insecticides et fongicides) :
L’agriculture consomme environ 500 substances actives dans plus de 8 000 produits commercialisés.
Les eaux superficielles ou souterraines destinées à la production d’eau potable doivent posséder, pour ne pas nécessiter de traitement spécifique pour les pesticides, des teneurs inférieures à 0,1 μg/L par pesticide (à l’exception de l’aldrine, la dieldrine, l’heptachlore et de l’heptachloroépoxyde pour lesquels la teneur maximale est de 0,03 μg/L) et de 0,5 μg/L pour la somme de tous les pesticides. Lorsque les teneurs sont comprises entre 0,1 et 2 μg/L par pesticide et de 0,5 à 5 μg/L pour la somme des pesticides, des traitements spécifiques sont nécessaires et au-dessus 2 μg/L, l’eau ne permet plus la production d’eau potable sauf dérogation. En 2014, en France, près de 700 molécules ont été recherchées dans les eaux superficielles.
Les teneurs des eaux de rivière en ces divers pesticides varient fortement au cours de l’année en fonction des traitements agricoles. L’atrazine, désherbant sélectif utilisé dans la culture du maïs, était, jusqu’à son interdiction en 2003, l’un des principaux pesticides polluant des eaux superficielles et souterraines. Il présentait l’inconvénient de ne pas pouvoir être facilement éliminé par les traitements classiques. En 2014, pour les eaux superficielles de France métropolitaine, les principaux pesticides dégradant la qualité des eaux sont principalement des herbicides avec en ordre décroissant : l’AMPA (acide aminométhylphosphonique, métabolite du glyphosate), l’atrazine déséthyl (métabolite de l’atrazine), le glyphosate, le métolachlore (interdit en France depuis 2003), la 2-hydroxyatrazine (métabolite de l’atrazine), l’isoproturon, l’atrazine… Pour les eaux souterraines : l’atrazine déséthyl (métabolite de l’atrazine), le déisopropyl-déséthyl-atrazine (métabolite de l’atrazine), l’atrazine…
Dans les cours d’eau des Départements d’Outre-Mer, les insecticides arrivent en tête, avec le chlordécone (interdit depuis 1993), l’hydrochlordécone (métabolite du chlordécone), …
En 2014, en France, 87 % des points de mesures ont montré la présence d’au moins un pesticide dans les eaux superficielles et 73 % pour les eaux souterraines.
Répartition des concentrations (c) en pesticides en fonction des teneurs, en µg/L, en 2007-09, en France :
| c < 0,1 | 0,1 c < 0,5 | 0,5 < c < 5 | c > 5 | |
| Cours d’eau de métropole | 47,8 % | 31 % | 20,5 % | 0,9 % |
| Eaux souterraines de métropole | 73,2 % | 22,6 % | 4,2 % | 0,05 % |
| Plans d’eau de métropole | 62,8 % | 26,1 % | 11,1 % | 0 % |
| Cours d’eau des DOM | 73 % | 9,5 % | 16,8 % | 0,7 % |
| Eaux souterraines des DOM | 64,8 % | 21,3 % | 10,6 % | 3,3 % |
Pollution microbiologique : contamination des eaux par des microorganismes pathogènes (bactéries, virus, parasites), susceptibles de provoquer des cas isolés de gastro-entérites voire une situation épidémique. La stratégie de contrôle de la qualité microbiologique des eaux est basée sur la recherche de « germes témoins de contamination fécale », faciles à détecter, non directement pathogènes mais dont la présence laisse supposer l’existence de microorganismes pathogènes pour l’homme. Il s’agit des deux indicateurs suivants : Escherichia coli et les entérocoques. Une eau est dite conforme aux limites de qualité microbiologique lorsqu’il y a absence d’Escherichia coli et d’entérocoques dans un échantillon de 100 mL d’eau. A l’échelon national, en part de population desservie, le taux de conformité microbiologique a progressé de 80 % en octobre 1991, à 86 % en octobre 1998, à 94,2 % en octobre 2002, 96,7 % en 2012 et 97,8 % en 2017.
Assainissement des eaux usées
La pollution des eaux usées est définie par un indicateur synthétique de matières organiques : l’équivalent habitant (Eh) qui correspond à 57 g de matière organique. En France, en 2016, la production d’eaux usées correspond à 79 millions d’Eh.
Une station d’assainissement produit, en moyenne, par jour et par habitant, 2,8 L de boue à 20 g/L de matière sèche soit, par an, en France 3 millions de t de boue qui ont donné, en 2016, 1 million de t de matière sèche qui à 44 % a été valorisée en agriculture, 36 % compostée, 17 % incinérée et 1 % placée en décharge. En 2016, le réseau collectif d’eaux usées et pluviales qui couvre 392 000 km a traité 5,8 milliards de m3 d’eaux usées dans 21 474 stations avec une capacité de 103 millions d’équivalents habitants (Eh).
En France, les eaux usées traitée sont déversées à 88 % dans des eaux de surface, 9 % sur des sols, 3 % dans des eaux côtières et des estuaires. Le taux de réutilisation de ces eaux traitées est très faible, < 1 %, alors que la moyenne européenne est de 2,4 % avec 9 % en Italie et 13 % en Espagne.
Carte de situation des stations françaises de traitement des eaux usées, fin 2018.
En France, en 2008, 82 % de la population est reliée à un réseau collectif, 17 % un réseau individuel et 1 % déversent directement leurs eaux usées dans la nature.
Dans le monde, par an, on estime que 450 km3 d’eaux usées sont déversés dans des cours d’eau sans avoir été épurés.
Élimination des composés azotés : à l’aide de procédés biologiques.
Les eaux usées contiennent de 30 à 50 mg de N/L principalement sous forme d’ions NH4+, qui peuvent être liés chimiquement, par exemple dans les protéines, ainsi que sous forme d’ions NO3–. Une première phase de nitrification transforme NH4+ en NO3– à l’aide de bactéries nitrifiantes, en présence de O2. Une deuxième phase de dénitrification est effectuée en absence de O2. Dans ces conditions (anoxie) une partie des micro-organismes présents dans les boues est capable de modifier son mode de respiration : au lieu d’utiliser O2 dissous, ces micro-organismes consomment l’oxygène des nitrates et donnent du diazote.
Élimination du phosphore, présent sous forme d’ions phosphates : 2 voies.
Physico-chimique : par précipitation à l’aide de chlorure ferrique, de sulfate d’aluminium ou de chaux. Le taux d’élimination est supérieur à 90 %.
Biologique : en créant un dérèglement du métabolisme intracellulaire des bactéries à l’aide d’un stress par privation de O2. Les bactéries ainsi stressées sont capables de renforcer fortement leur capacité d’absorption du phosphore. Le traitement a lieu en 3 phases : anaérobie (phase de stress), anoxie (absence de O2, présence de NO3–), aérobie. Le taux d’élimination est compris entre 40 et 92 %. En général, les 2 voies sont associées, le traitement biologique permettant de diminuer la consommation de réactifs chimiques et la production de boues résultant de ce traitement.
Bibliographie
- Centre d’Information sur l’eau, BP 10005, 75362 Paris Cedex 08.
- « Les prélèvements d’eau douce en France« , DataLab, SOes, janvier 2017.
- Eau France, le portail de l’eau.
- Office français de la Biodiversité, 12 cours Lumière, 94300 Vincennes.
- Conseil mondial de l’eau, Espace Gaymard, 2-4 place d’Arviaux, 13002 Marseille.
- Aquastat, FAO, Viale delle Terme di Caracalla, 00153 Rome, Italie.
- Les services publics d’eau et d’assainissement en France. Données économiques, sociales et environnementales, BIPE et Entreprises de l’eau, 7ème éd., 2019.
- R. Clayton, « Desalination for water supply » Foundation for Water Research, 3ème édition, juin 2015.
- International Desalination Association (IDA), P.O. Box 387, 94 Central Street, Suite 200, Topsfield, MA 01983, États-Unis.
- Syndicat des Eaux de Sources et des eaux minérales naturelles, 2 rue Jean Lantier, 75001 Paris.
- Maison des Eaux Minérales Naturelles, 9 Bd Malesherbes, 75008 Paris.
- Natural Mineral Waters Europe, place des Barricades 1, B-1000 Bruxelles, Belgique.
- International Bottled Water Association (IBWA), 1700 Diagonal Road, Suite 650, Alexandria, VA 22314, États-Unis.
- J.G. Rodwan, « Bottled water 2019« .
- Le point sur l’analyse spatiale des pressions agricoles : surplus d’azote et gaz à effet de serre, Observation et Statistiques, Commissariat Général au Développement Durable, n°113, mars 2012.
- NOPOLU-Agri, outil de spatialisation des pressions de l’agriculture, méthodologie et résultats pour les surplus d’azote et les émissions des gaz à effet de serre, campagne 2010-2011, Observation et Statistiques, Commissariat Général au Développement Durable, document de travail, septembre 2013.
- Les pesticides dans les cours d’eau français, en 2013, Chiffres et Statistiques n°697, Commissariat Général au Développement Durable, novembre 2015.
- Bilan de présence des micropolluants dans les milieux aquatiques continentaux, période 2007-2009, Observation et Statistiques, Commissariat Général au Développement Durable, n°54, octobre 2011.
- Observatoire des services publics d’eau et d’assainissement : panorama des services et de leurs performances en 2015, Eau France, septembre 2018.
Archives
Peroxyde d’hydrogène
Données physico-chimiques
Données atomiques
| Formule | Masse molaire | Distances interatomiques, en phase gazeuse |
Angles, en phase gazeuse |
Moment dipolaire |
| H2O2 | 34,01 g.mol-1 | O-O : 147 pm O-H : 95 pm |
OO-H : 94,8° les H étant situés dans 2 plans faisant un angle de 115,5° | 1,573 D |
Données physiques
| Masse volumique | Température de fusion | Température d’ébullition | Solubilité dans l’eau |
| 1,442 g.L-1 | -0,41°C | 150,2°C | infinie |
Données chimiques
| pKa : H2O2/HO2– | E° : O2(g) + 2H+ + 2e = H2O2 | E° : H2O2 + 2H+ + 2e = 2H2O |
| 11,65 | 0,69 V | 1,77 V |
Données thermodynamiques
Peroxyde d’hydrogène liquide :
|
Peroxyde d’hydrogène gazeux :
Peroxyde d’hydrogène en solution aqueuse :
|
Données industrielles
La solution aqueuse de peroxyde d’hydrogène est l’eau oxygénée.
Matières premières
Le dioxygène de l’air et le dihydrogène.
Le dihydrogène utilisé pour fabriquer le peroxyde d’hydrogène et sa solution aqueuse, l’eau oxygénée, doit être d’une grande pureté. Souvent celui employé est coproduit lors de l’électrolyse du chlorure de sodium afin d’obtenir le dichlore, l’hypochlorite de sodium ou le chlorate de sodium. Par exemple, l’usine de Jarrie (38) exploitée par Arkema en France, utilise du dihydrogène coproduit lors de la fabrication de chlorate de sodium.
Fabrication industrielle
Elle est réalisée, quasi exclusivement, selon le procédé d’auto-oxydation basé sur la réduction d’une alkylanthraquinone en anthraquinol suivie de son oxydation. Lors de cette réaction, l’anthraquinone est régénérée et le peroxyde d’hydrogène se forme.
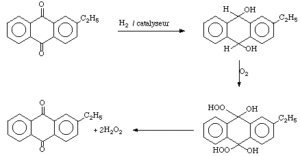
La solution d’alkylanthraquinone, en général l’éthyl-2 anthraquinone, dans un solvant organique non miscible dans l’eau est hydrogénée en présence de catalyseur (palladium sur alumine) en hydroquinone qui est oxydée par le dioxygène de l’air en un mélange d’hydroxyhydroperoxydes qui sont décomposés en H2O2 et quinone de départ qui est recyclée. H2O2 est séparé de la phase organique par extraction à l’eau (à ce niveau la concentration en H2O2 peut atteindre 47 % en masse), puis concentré par distillation afin d’obtenir les diverses solutions commerciales, en général à 70 % en masse soit 900 g de H2O2/L de solution.
Les pressions sont proches de la pression atmosphérique et les températures d’hydrogénation et d’oxydation comprises entre 60 et 80°C. Le rendement par rapport au dihydrogène est supérieur à 95 %. Des réactions secondaires entraînent une faible consommation d’anthraquinone qui peut être notablement réduite par l’utilisation d’un traitement catalytique annexe de reconversion. Les réactions de production de H2O2 étant exothermiques, les réacteurs, en aluminium ou acier inoxydable, sont refroidis par de l’eau.
Capacités des unités de production : on distingue 3 types d’usines.
- Des méga-usines, avec des capacités de production comprises entre 200 000 et 350 000 t/an destinées à produire de l’oxyde de propylène, pour, principalement, la fabrication de polyuréthane ou de propylène glycol, par réaction entre le propylène et le peroxyde d’hydrogène, selon le procédé HPPO, par exemple pour celles exploitées, en joint venture, par Solvay, en Belgique, à Anvers (230 000 t/an), en Thaïlande, à Map Ta Phut (330 000 t/an) et en Arabie Saoudite, à Jubail (300 000 t/an). La première méga-usine a été construite, en 2008, par Evonik, à Ulsan, en Corée du Sud pour alimenter l’usine de SKC.
- Des usines standards avec des capacités de production de 70 000 à 100 000 t/an.
- Des productions sur site, en général de production de pâte à papier, possédant des capacités de production plus faibles, de 8 000 à 18 000 t/an, par exemple pour Solvay avec 12 000 t/an destinées à la société Suzano Papel e Celulose à Imperatriz, dans l’État de Maranhão au Brésil.
Conditionnement :
Il est réalisé dans des citernes ou des fûts en aluminium, acier inoxydable austénitique (par exemple 304 L) ou polyéthylène haute densité. Les concentrations les plus couramment commercialisées par les producteurs sont de 35 et 70 % de H2O2 (des concentrations de 85 % peuvent être livrées).
Définition de la concentration des solutions de H2O2, exprimée en volume : c’est le nombre de litres de dioxygène gazeux mesuré à 0°C et 1 atm donné par un litre de solution de H2O2 à 20°C selon l’équation chimique :
2 H2O2 = 2 H2O + O2
| Teneur en H2O2 en g pour 100 g de solution | 3 | 30 | 70 |
| Concentration en volume | 10 | 110 | 298 |
| Masse volumique à 25°C en g.cm-3 | 1,007 | 1,108 | 1,284 |
Propriétés
La propriété la plus utilisée des solutions de H2O2 est le pouvoir oxydant qui permet d’oxyder de nombreux composés organiques (colorants…) et minéraux. H2O2 est également réducteur vis à vis d’agents oxydants forts. Il peut former, par transfert du groupement peroxyde, d’autres peroxydes organiques ou inorganiques. Il peut également former des composés d’addition (perborates et percarbonates) et donner du dioxygène et de l’eau par décomposition.
Ces propriétés en font un agent de blanchiment « écologique », les produits formés, dioxygène et eau, étant non polluants.
Stabilité : les solutions commerciales de H2O2 sont stables tant qu’elles restent pures, mais de nombreux facteurs agissent sur leur stabilité.
- Catalyseurs de décomposition : la plupart des métaux (sauf l’aluminium et l’acier inoxydable) et en particulier : Fe, Cu, Ni, Zn, Mn, Cr, V, W, Mo, Ag, Pt, les oxydes et hydroxydes des métaux lourds, à de très faibles teneurs (de l’ordre de quelques ppm), suffisent souvent à provoquer une décomposition rapide. Pour cette raison, H2O2 doit être dilué à l’aide d’eau déminéralisée et non distillée (la distillation étant souvent effectuée dans des appareils en cuivre). Afin de minimiser la décomposition de H2O2 entraînée par une possible pollution, des stabilisants (complexants de métaux, par exemple du pyrophosphate de sodium) sont ajoutés aux solutions commerciales.
- L’élévation de température, la lumière, des pH > 5 favorisent également la décomposition.
Productions
Elles sont, en général, exprimées en H2O2 à 100 %, sauf pour les données sur le commerce international collectées par l’ITC.
En 2015, les capacités de production mondiales sont estimées à 5,5 millions de t/an.
En 2024, la production de l’Union européenne a été de 1,212 million de t dans les pays suivants :
| Belgique | 314 837 | Pays Bas | 87 271 | |
| Suède, en 2021 | 206 497 | Espagne, en 2023 | 40 167 | |
| Allemagne | 173 764 | Italie | 38 231 | |
| Finlande | 113 289 | République tchèque | 36 578 |
Pour les autres pays de l’Union européenne, dont la France, les productions sont confidentielles ou nulles.
En 2017, la production du Canada est de 239 452 t, celle du Japon, en 2018, de 179 540 t, celle de l’Inde, en 2019, de 156 540 t.
| Belgique | 239 963 | Allemagne | 115 835 | |
| Corée du Sud | 184 214 | Thaïlande | 107 958 | |
| Pays Bas | 174 330 | Canada | 101 714 | |
| Brésil | 128 249 | Bangladesh | 65 447 | |
| Suède | 125 974 | Autriche | 65 098 |
| Allemagne | 339 448 | Autriche | 58 680 | |
| États-Unis | 105 800 | Royaume Uni | 52 702 | |
| Vietnam | 73 491 | Taipei chinois | 52 012 | |
| Israël | 63 582 | Indonésie | 49 812 | |
| France | 62 054 | Pays Bas | 48 976 |
Principaux producteurs :
| Solvay (Belgique) | 1 365 | Arkema (France) | 440 | |
| Evonik Industries (Allemagne) | 950 | Peroxychem (États-Unis) | 200 | |
| Mitsubishi Gas Chemical (Japon) | 489 | Nouryon (Pays Bas) | 200 |
Sources : Merchant Research & Consulting et rapports des sociétés
Solvay, n°1 mondial, produit H2O2 dans 18 usines, en Belgique (Jemeppe sur Sambre et Zandvliet (Anvers) dans une joint venture avec BASF et Dow avec 230 000 t/an), aux Pays Bas (Linne Herten), au Royaume-Uni (Warrington), au Portugal (Povoa de Santa Iria), en Allemagne (Bernburg), en Italie (Rosignano), en Finlande (Voikkaa), aux États-Unis (Deer Park (LaPorte) au Texas et Longview dans l’État de Washington, avec 187 000 t/an), en Chine (à Zhenjiang, province de Shandong avec 60 000 t/an), en Australie (Banksmeadow (Sidney)), en Thaïlande (Map Ta Phut en joint venture avec Dow avec 330 000 t/an), en Arabie Saoudite (Jubail, avec 300 000 t/an), en association avec Sadara (joint venture entre Saudi Aramco et Dow). Au Brésil, à Curitiba, dans l’État de Paraná, Solvay détient 70 % d’une joint venture, Peróxidos do Brasil, en association pour 30 % avec Produtos Químicos Makay, avec une capacité de production de 230 000 t/an.
Evonik, n°2 mondial, avec une capacité de production de 950 000 t/an exploite 13 usines à travers le monde, aux États-Unis à Mobile dans l’Alabama, au Canada, à Gibbons dans l’Alberta et Maitland dans l’Ontario, en Afrique du Sud à Umbogintwini, au Brésil à Barra do Riacho, en Chine dans la province de Jilin, pour produire de l’oxyde de propylène selon le procédé HPPO, avec 230 000 t/an, en Corée du Sud à Ulsan, pour produire de l’oxyde de propylène selon le procédé HPPO, en Indonésie à Cikarang, en Nouvelle Zélande à Morrinsville, en Allemagne à Rheinfelden, en Belgique à Anvers, en Autriche à Weissenstein, aux Pays Bas à Delfzijl. En février 2020 a finalisé l’achat de Peroxychem (ex-FMC) avec des unités de production aux États-Unis, à Bayport au Texas et Saratoga Springs dans l’État de New York, en Espagne à La Zaida, dans la province de Zaragoza et dans une joint-venture, en Thaïlande à Saraburi avec Aditya Birla, avec 19 000 t/an. L’usine canadienne de Peroxychem de Prince George, en Colombie Britannique, non comprise dans l’achat, a été vendue à United Initiators.
Mitsubishi Gas Chemical produit du peroxyde d’hydrogène de pureté standard au Japon, à Yokkaichi, avec 18 000 t/an, Kashima, avec 104 000 t/an et Tomakomai, avec 33 000 t/an, en Indonésie, avec 12 000 t/an et en Chine avec 30 000 t/an. Par ailleurs, produit du peroxyde d’hydrogène ultra pur, au Japon à Yamakita, avec 30 000 t/an, Saga, avec 19 000 t/an et Yokkaichi, avec 12 000 t/an, en Corée du Sud, avec 120 000 t/an, à Singapour, avec 10 000 t/an, à Taipei chinois, avec 31 000 t/an et aux États-Unis, avec 70 000 t/an. Deux nouvelles usines de production de produit ultra pur, de 35 000 t/an chaque, ont été construites en 2019, dans l’Oregon et le Texas.
Arkema exploite 5 usines dont, en France, l’unité de production de Jarrie (38), d’une capacité de 115 000 t/an. Produit également H2O2 au Canada à Bécancour, au Québec, avec 80 000 t/an de capacité, aux États-Unis, à Memphis dans le Tennessee, avec 70 000 t/an, en Chine, à Shanghai avec 66,6 % d’une joint venture avec Shangai Coking and Chemical Corporation (SCCC) et 80 000 t/an, ainsi qu’en Allemagne à Leuna, près de Leipzig avec 80 000 t/an.
Nouryon issu en octobre 2018 de AkzoNobel produit du peroxyde d’hydrogène en Norvège, à Rjukan, en Suède, à Bohus et Alby et aux États-Unis, à Colombus dans le Mississippi, avec une capacité de production de 64 000 t/an.
Situation française
Capacités de production : 115 000 t/an, par Arkema à Jarrie (38).
Commerce extérieur : en 100 % H2O2, en 2024.
Les exportations s’élevaient à 36 074 t à destination principalement à :
- 31 % d’Allemagne,
- 20 % d’Italie,
- 20 % d’Espagne,
- 8 % de Suisse,
- 5 % de Slovaquie.
Les importations s’élevaient à 32 480 t en provenance principalement à :
- 40 % d’Allemagne,
- 19 % de Belgique,
- 16 % des Pays Bas,
- 15 % d’Espagne,
- 5 % de Finlande.
Utilisations
Consommation : dans le monde, en 2020, 5,187 millions de t. Répartition de la consommation, en 2021 :
| Chine | 45 % | Amérique du Nord | 10 % | |
| Europe de l’ouest | 16 % | Autres pays asiatiques | 8 % |
Source : IHS Markit
Secteurs d’utilisation du peroxyde d’hydrogène : en 2020, dans le monde.
Secteurs d’utilisation du peroxyde d’hydrogène
En 2020, dans le monde (source : Mordor Intelligence)
| Pâte à papier et papiers | 43 % | Traitement des eaux | 7 % |
| Synthèse de l’oxyde de propylène | 20 % | Alimentation, boissons | 4 % |
| Textiles | 12 % | Mines | 3 % |
| Cosmétiques, santé | 8 % | Autres | 3 % |
Source : Mordor Intelligence
Utilisations diverses :
- Blanchiment des pâtes à papier : H2O2 est utilisé pour les pâtes mécaniques, il se substitue partiellement à Cl2, ClO2 et HClO pour les pâtes chimiques. Il s’emploie dans tous les procédés de désencrage des vieux papiers. Les consommations moyennes de H2O2 sont, pour une tonne de pâte, de 0,9 kg en association avec Cl2, de 4,1 kg en association avec ClO2 et de 20 kg pour les pâtes sans chlore (« totally chlorine-free »). Voir le chapitre consacré au chlorate de sodium.
- Blanchiment des textiles : fibres cellulosiques naturelles, laine, soie, fibres artificielles… De 80 à 90 % des fibres de coton sont blanchies à l’aide de solutions aqueuses de peroxyde d’hydrogène à une teneur comprise entre 0,3 à 0,6 %, à pH de 10,5 à 11,5 et à 90-95°C.
- Fabrication de produits de blanchiment pour poudres de lavage : perborates de sodium mono et tétrahydratés et percarbonate de sodium. Ils entrent à des teneurs de 15 à 20 % en masse dans les lessives (voir le chapitre consacré aux borates).
- La production d’oxyde de propylène, destiné principalement à la production de polyuréthane et de propylène glycol, par réaction entre le propylène et le peroxyde d’hydrogène, selon le procédé HPPO (Hydrogen-Peroxide-to-Propylene-Oxide), se développe et diverses usines de production de peroxyde d’hydrogène destinées à cet usage ont été construite, par exemple, en 2008, par Solvay, BASF et Dow, à Anvers, en Belgique et par Evonik à Ulsan en Corée du Sud. Ce procédé permet de produire de l’oxyde de propylène sans coproduction de styrène ou d’alcool tertiobutylique, selon la réaction :
CH2CH3CH + H2O2 = CH3C2H3O + H2O
- Traitement des eaux usées : H2O2 permet, en particulier, d’éviter la formation de H2S dans les eaux usées (si le milieu est anaérobie), de détruire les ions cyanures, nitrites, les phénols…
- Traitement des eaux potables : par exemple, le sud de la ville de Sao Paulo (Brésil) est alimenté avec un débit de 16 m3.s-1 par un lac artificiel où des algues prolifèrent. Une pulvérisation de H2O2 traitant 1 km2.h-1 élimine ces algues.
- Désulfuration et dénitrification des fumées, par lavage des gaz.
- Métallurgie : H2O2, décomposé rapidement en présence d’ions métalliques, est utilisé après avoir été transformé en acide de Caro (acide peroxomonosulfurique). L’opération est, en général, effectuée sur les lieux d’utilisation selon la réaction :
H2O2 + H2SO4= H2SO5 + H2O.
L’acide de Caro est utilisé pour oxyder U+IV insoluble en U+VI soluble, lors des opérations d’extraction de l’uranium de son minerai, pour séparer Co2+ de solutions de Ni par formation d’hydroxyde de Co3+ insoluble, pour séparer Mn2+ de solutions de Co et Zn par formation de MnO2 insoluble…
- H2O2 est également utilisé pour décaper les tôles et fils d’acier inoxydable en remplacement de l’acide nitrique (procédé UG3P – Ugine Peroxyd Pickling Process, mis au point par Ugine à Gueugnon). Consommation de 1 à 2 kg de H2O2/t d’acier.
- Chimie : synthèse de l’acide peracétique, de l’huile de soja époxydée utilisée comme stabilisant du PVC, d’hydrazine, d’hydroquinone et de pyrocatéchol par hydroxylation de noyaux aromatiques, de peroxydes organiques et inorganiques.
- Antiseptique pharmaceutique : c’est une de ses plus anciennes applications, il est hémostatique et bactériolytique.
- Stérilisation, en phase vapeur, des matériels et emballages agroalimentaires : lait UHT, jus d’orange… en emballages carton.
- Décontamination in situ des sols par injection d’eau oxygénée, par exemple, en Alsace, sur le site de l’ancienne raffinerie d’Herlisheim.
- Lutte contre la pandémie au covid-19 : la solution hydro-alcoolique d’antisepsie des mains recommandée par l’OMS a la composition suivante pour un volume de 10 litres : éthanol à 96 % : 8 333 mL, peroxyde d’hydrogène à 3 % : 417 mL, glycérol à 98 % : 145 mL, compléter à 10 L avec de l’eau permutée ou de l’eau bouillie refroidie.
- Le peroxyde d’hydrogène de haute pureté est employé pour nettoyer et graver les plaques de silicium en microélectronique. Solvay exploite deux unités en Asie (à Suzhou en Chine et Map Ta Phut en Thaïlande), une unité aux États-Unis à Deer Park (Texas) ainsi qu’une unité à Bernburg en Allemagne. Les produits peroxydés de haute pureté produits dans ces sites, ont des teneurs en impuretés variant de moins de 100 ppb à moins de 0,1 ppb en cations contaminants.
Bibliographie
- J.M. Campos-Martin, G. Blanco-Brieva, J.L.G. Fierro, « Hydrogen peroxide synthesis : an outlook beyond the anthraquinone process« , Angew. Chem. Int. Ed., 2006, 45, 6962-6984.
- F. Schmidt, et al, « HPPO process technology. A novel route to propylene oxide without coproducts », Chimica Oggi, vol 32 (2), mars/avril 2014.
- Formulation des produits hydro-alcooliques recommandés par l’OMS.
Archives
Dioxygène
Données physico-chimiques
Données atomiques
| Formule | Masse molaire | Distance interatomique |
| O2 | 31,998 g.mol-1 | 121 pm |
Données physiques
| Masse volumique | Température de fusion | Température de sublimation | Température critique | Pression critique | Température point triple | Pression point triple | Conductibilité thermique | Solubilité dans l’eau |
|
-218,4°C | -182,96°C | -118,57°C | 5 043 kPa | -218,79°C | 0,15 kPa | 0,02674 W.m-1K-1 |
|
Données chimiques
| pKa : HO2/O2– | pKa : HO/O2– |
| 4,4 | 12 |
Potentiels standards :
| O3(g) + 2H+ + 2e = O2(g) + H2O | E° = 2,07 V |
| O2(g) + 2H+ + 2e = H2O2 | E° = 0,69 V |
| O2(g) + H2O + 2e = OH– + HO2– | E° = -0,076 V |
| O2(g) + 4H+ + 4e = 2H2O | E° = 1,229 V |
| O2(g) + 2H2O + 4e = 4OH– | E° = 0,401 V |
Données thermodynamiques
Dioxygène gazeux :
|
Dioxygène en solution aqueuse :
|
Données industrielles
État naturel
L’oxygène est l’élément le plus répandu sur terre. Il représente :
- 46,4 %, en masse, de la croûte terrestre, sous forme d’oxydes, silicates…
- 88,9 %, en masse, de l’eau (dans la molécule H2O), ainsi que sous forme de dioxygène, en solution (8 mg/L à 20°C).
- 62,5 %, en masse, du corps humain (88 % chez certains animaux marins) principalement dans la molécule d’eau.
- 23,1 %, en masse, de l’air, sous forme de dioxygène, soit 1,2 1015 t.
Composition de l’air sec
(en % volume et masse. Masse de l’atmosphère : 5,13 1015 t)
| Gaz | % en volume | % en masse | Gaz | % en volume | % en masse | |||
| Diazote | 78,09 | 75,52 | Krypton | 1,0.10-4 | 3,3.10-4 | |||
| Dioxygène | 20,95 | 23,14 | Dihydrogène | 5,0.10-5 | 0,3.10-5 | |||
| Argon | 0,93 | 1,29 | Hémioxyde d’azote | 2,7.10-5 | 4,1.10-5 | |||
| Dioxyde de carbone | 0,03 | 0,05 | Oxyde de carbone | 1,9.10-5 | 1,9.10-5 | |||
| Néon | 1,8.10-3 | 1,3.10-3 | Xénon | 8,0.10-6 | 40.10-6 | |||
| Hélium | 5,2.10-4 | 0,7.10-4 | Ozone | 1,0.10-6 | 1,6.10-6 | |||
| Méthane | 1,5.10-4 | 0,8.10-4 | Radon | 6,0.10-18 | 50.10-18 |
La teneur moyenne en vapeur d’eau est de 0,53 % en volume (0,33 % en masse) et varie de 0,1 % en Sibérie à 5 % dans des régions côtières équatoriales.
Épaisseur de l’atmosphère : en % de la masse atmosphérique située au-dessous d’une altitude donnée.
| 50 % | 67 % | 75 % | 90 % | 99 % | ||||
| 5 500 m | 8 400 m | 10 300 m | 16 100 m | 31 000 m |
Fabrication industrielle
L’obtention du dioxygène est réalisée principalement (à 95 %) par voie cryogénique par séparation des gaz de l’air.
Principe de la voie cryogénique : par liquéfaction de l’air suivie d’une distillation fractionnée.
Les températures critiques du diazote (tc = – 146,9°C) et du dioxygène (tc = – 118,4°C) ne permettent pas la liquéfaction de l’air par simple compression. L’air, comprimé entre 5 et 7 bar, est filtré, séché, décarbonaté par adsorption sur tamis moléculaires puis refroidi par échange thermique entre le gaz entrant et les gaz liquéfiés. Les pertes frigorifiques sont compensées par détente de 5 à 10 % du débit gazeux traité dans une turbine avec travail extérieur récupérable.
La distillation, dans le procédé le plus utilisé, est effectuée dans une double colonne qui permet d’obtenir, en continu, des gaz purs. La première colonne, sous une pression moyenne de 5 bar, réalise une première séparation de l’air en diazote gazeux pur (99,999 %) au sommet et un liquide riche en dioxygène, avec une teneur d’environ 40 %, à la base, qui est envoyé à mi-hauteur de la deuxième colonne sous une pression basse de 1,3 bar. Le dioxygène à 99,5-99,7 % est récupéré à la base de cette colonne. Il contient moins de 1 ppm de diazote, la principale impureté est l’argon.
Les colonnes ont entre 1 et 6 m de diamètre et de 15 à 25 m de hauteur. Elles sont en acier inoxydable ou en aluminium et comportent une centaine de plateaux. L’isolation thermique est réalisée avec de la perlite, le maintien en température ne consomme que 6 à 7 % de l’énergie totale dépensée.
La consommation d’énergie est de 0,4 kWh/m3 de O2 gazeux, soit de 50 à 60 % du prix de revient.
Les capacités de production des unités les plus importantes, appelées oxytonnes, atteignent 5 000 t de O2/jour et 8 000 t de N2/jour.
Début 2018, est entré en production une unité de 5 000 t O2/jour, la plus importante dans le monde, construite et exploitée par Air Liquide, à Secunda, en Afrique du Sud, afin d’approvisionner le groupe chimique Sasol. Au total, Air Liquide fournit à Sasol, 45 000 t/jour de dioxygène.
En France, la première production industrielle de dioxygène a été effectuée par Georges Claude, le 23 avril 1905 à Boulogne-Billancourt. Il a recueilli 280 m3 de O2 à 93 % de pureté.
La distillation des gaz de l’air produit simultanément O2, N2, ainsi que des gaz rares, le principal étant l’argon, avec une teneur de 0,93 % en volume dans l’air. La production est commandée par le gaz le plus demandé, l’excès de production des autres gaz étant relâché dans l’atmosphère.
Exemple de l’usine Air Liquide de Seraing (Liège, Belgique) connectée au réseau nord européen de cette société. La capacité est de 1 100 t/jour de dioxygène.
| Capacité (m3/h) | Pureté | ||
| Dioxygène gazeux | 30 600 | 99,6 % | |
| Diazote gazeux | 40 500 | 1 ppm de O2 maximum | |
| Argon liquide | 1 170 | 5 ppm d’impuretés | |
| Diazote liquide | 17 500 | 1 ppm de O2 maximum | |
| Dioxygène liquide | 250 | 5 ppm d’impureté maximum |
Procédé non-cryogénique :
Il est dénommé VPSA (Vacuum Pressure Swing Adsorption) ou adsorption par alternance de pression et vide. L’air, à la pression atmosphérique, après séchage et épuration par filtration, passe dans une colonne de zéolithes qui adsorbent plus rapidement N2 que O2. Les zéolites, par kg, peuvent fixer 10 L de diazote. Lorsqu’elles sont saturées, l’air est envoyé sur une seconde colonne, pendant que le N2 de la première colonne désorbe sous vide. La pureté de O2 obtenu ainsi par élimination de N2 peut atteindre 90 à 95 %. Il contient 4,5 % d’argon qui comme O2 n’est pas adsorbé. La consommation d’énergie est de 0,4 à 0,5 kWh/m3 de O2. Ce procédé est de plus en plus employé dans des procédés industriels dont les besoins sont d’environ 1000 t/jour, ainsi que, par exemple, dans les respirateurs utilisés à domicile.
Choix des diverses sources d’approvisionnement : en fonction de la pureté et du débit souhaités.
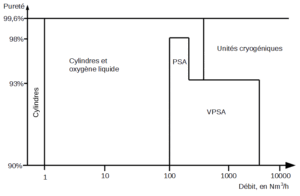
Conditionnement et distribution : le dioxygène, ainsi que le diazote et l’argon, sont produits, par voie cryogénique, dans un nombre réduit d’unités de production (une vingtaine en France) et distribués selon trois modes :
- Par oxyducs : en France, environ 45 % de la production industrielle de dioxygène est acheminée par canalisation. Le réseau mondial de canalisations de dioxygène et de diazote, en Allemagne, Benelux, États-Unis, France (dans le Nord et en Lorraine, voir cartes ci-dessous), Royaume Uni, Italie… est de plus de 8 500 km dont 5 500 km exploités par Air Liquide, 1 200 km par Air Products, 1 120 km par Taiyo Nippon Sanso, 500 km par Messer.
Réseau Est d’Air Liquide (d’après un document de cette société que nous remercions)
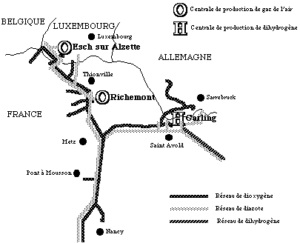
Réseau Nord d’Air Liquide (d’après un document de cette société que nous remercions)
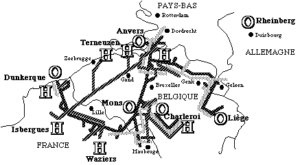
- Par camions, sous forme liquide, dans un rayon de 200 à 250 km : environ 35 % de la production française.
- Comprimé en bouteilles, à 200 bar : environ 20 % de la production française. Les bouteilles sont remplies, par des centres de conditionnement, à partir de liquide livré par camion.
- Le dioxygène et le diazote peuvent également être produits in situ, principalement par voie non-cryogénique, dans des unités destinées à approvisionner directement un utilisateur.
Productions
Dans le monde, la production est estimée à 300 millions t/an soit 2,5/10 millions du dioxygène de l’atmosphère.
En 2024, la production de l’Union européenne est de 29,727 millions de t* dont :
| Allemagne | 7 668 | Pologne | 1 683 | |
| Belgique | 3 187 | Finlande | 1 550 | |
| Pays Bas | 2 732 | Autriche | 1 079 | |
| Espagne | 2 073 | République tchèque | 1 052 | |
| Italie | 2 036 | Roumanie | 490 |
Source : statistiques Prodcom de l’Union européenne
* : les données statistiques de l’Union européenne sont exprimées en m3, dans les conditions normales (0°C, 1,013 bar), dans ces conditions la masse volumique du dioxygène est de 1,4287 kg.m–3.
La production française est confidentielle, ainsi que celle de la Slovaquie.
En 2020, la production du Japon est de 13,877 millions de t.
Évolution de la demande annuelle de gaz de l’air aux États-Unis :
| Années | Dioxygène | Diazote | Argon | |||
| 1966 | 10 millions de t | 3 millions de t | 100 000 t | |||
| 1981 | 16 millions de t | 16 millions de t | ||||
| 1985 | 15 millions de t | 24 millions de t | 500 000 t | |||
| 1996 | 27 millions de t | 36,5 millions de t | ||||
| 2004 | 29,3 millions de t | 33,4 millions de t |
Commerce international : en 2024.
Principaux pays exportateurs :
| France | 368 088 | Bulgarie | 24 646 | |
| Belgique | 100 103 | Autriche | 24 280 | |
| Allemagne | 62 268 | Pologne | 24 262 | |
| Portugal | 47 449 | Croatie | 22 433 | |
| Koweït | 25 451 | Singapour | 19 906 |
Source : ITC
Les exportations belges sont destinées à 87 % aux Pays Bas, 7 % à la France, 4 % au Royaume Uni.
Principaux pays importateurs :
| Luxembourg | 205 693 | Slovénie | 27 531 | |
| Allemagne | 190 442 | Arabie Saoudite | 26 604 | |
| Slovaquie | 52 986 | Pays Bas | 22 482 | |
| Canada | 41 945 | France | 14 472 | |
| Grèce | 37 979 | Autriche | 13 895 |
Source : ITC
Les importations du Luxembourg proviennent à 97 % de France, 2 % d’Allemagne, 2 % de Belgique.
Principaux producteurs : environ 60 % de la production de dioxygène est assurée directement par les industries consommatrices.
- Linde : AGA (Suède) et BOC (Royaume-Uni) ont été racheté par Linde respectivement en 2000 et 2006. La fusion entre Linde et Praxair est effective depuis fin 2018. Le groupe après fusion est devenu n°1 mondial des gaz industriels avec environ 24 % du marché, suivi par Air Liquide avec 18 %, Air Products avec 7 %. Les utilisations captives représentant 31 %. Linde exploitait 320 grandes unités cryogéniques de séparation des gaz de l’air, dont 150 en Europe, Moyen Orient et Afrique, 110 en Asie, Pacifique et 60 en Amériques. Praxair était n°1 des gaz industriels en Amérique du Nord et du Sud et exploitait, en Europe, 60 grandes unités cryogéniques de séparation des gaz de l’air et 3 pipeline, au Nord de l’Espagne et en Allemagne dans la région rhénane et la Sarre. Exploitait en Amérique du Sud 50 grandes unités cryogéniques de séparation des gaz de l’air et 50 en Asie. Dans le cadre de cette fusion les usines européenne de Praxair ont été cédée à Nippon Gases, filiale de Taiyo Nippon Sanso et les 32 usines de liquéfaction des gaz de l’air de Linde aux États-Unis ont été cédées à Messer.
- Air Liquide : dans le monde, les capacités de production du groupe sont de plus de 130 000 t/jour, avec, en 2021, 373 grandes unités cryogéniques de séparation des gaz de l’air, dont 22 en Allemagne. En mai 2016, Air Liquide a finalisé l’acquisition du groupe américain Airgas.
- Air Products : exploite, dans le monde, plus de 300 grandes unités cryogéniques de séparation des gaz de l’air.
- Autres producteurs importants : Taiyo Nippon Sanso (filiale de Mitsubishi Chemical, Japon), Messer (Allemagne), Yingde (Chine), Hangzhou Hangyang (Chine).
Situation française
Production, en 2011 : 1,646 million de t.
Commerce extérieur : en 2024.
Les exportations étaient de 368 088 t avec comme principaux marchés à :
- 50 % l’Allemagne,
- 49 % le Luxembourg.
Les importations s’élevaient à 14 472 t en provenance principalement à :
- 22 % de Belgique,
- 21 % d’Allemagne,
- 9 % d’Espagne.
Producteurs et sites de production :
- Air Liquide : 14 usines cryogéniques de séparation des gaz de l’air, en métropole et une usine à Kourou, en Guyane. Les usines de métropole sont située à :
- Moissy-Cramayel (77)
- Montoir-de-Bretagne (44)
- Sandouville (76)
- Pardies (64)
- Lacq (64)
- Tarnos (40)
- Richemont (57)
- Fos Tonkin (13) : la liquéfaction de l’air est assurée à l’aide du froid apporté par le gaz naturel liquéfié lors de sa regazéification dans les installation du terminal méthanier proche.
- Fos Audience (13)
- Pierrelatte (26)
- Feysin (69)
- Jarrie (38)
- Tavaux (39)
- Dunkerque (59).
- Air Products : à Schiltigheim (67) avec 650 t/j, L’Isle d’Abeau (38) avec 665 t/j, en association avec Messer et possède une participation de 50 % dans la société Soprogaz, en association avec Messer, qui exploite une usine à Beauvais (60) de 600 t/jour.
- Messer : à Beauvais (60), avec 300 t/jour, en association avec Air Products et Saint-Herblain (44), avec 300 t/jour, en association avec Linde. A repris, en mars 2014, les activités françaises de Praxair, avec les unités de production de Creil (60), avec 500 t/jour, L’Isle d’Abeau (38), avec 665 t/jour, en association avec Air Products et Strasbourg (67).
- Linde : usines de production à Salaise sur Sanne (38) et Montereau (77) ainsi qu’à Saint-Herblain (44), 300 t/jour, en association avec Messer.
Utilisations
Les principales utilisations sont les suivantes :
- Sidérurgie : c’est le principal secteur d’utilisation du dioxygène, dans l’élaboration de l’acier dans les convertisseurs mais aussi dans les hauts fourneaux. Cette industrie utilise environ la moitié de la production de O2 (la consommation est d’environ 60 m3 de O2 par t d’acier). Par exemple, Air Liquide approvisionne en dioxygène un important producteur mondial d’acier (Pohang Iron and Steel Company ou POSCO, Corée du Sud) à l’aide de 11 unités d’une capacité totale de 7 800 t/j.
- Combustions : le remplacement de l’air par le dioxygène pur permet d’atteindre des températures plus élevées, d’économiser de l’énergie (le volume de diazote non utilisé n’est pas chauffé) et d’éviter la pollution due aux poussières entraînées par le diazote rejeté dans l’atmosphère et à la formation d’oxydes d’azote. Dans les fours de l’industrie verrière, le remplacement de l’air par du dioxygène lors de la combustion permet de diviser par 5 à 10 les émissions d’oxydes d’azote.
- Chimie : dans la production d’oxyde d’éthylène, d’oxyde de propylène, de chlorure de vinyle par oxychloration, de dioxyde de titane par le procédé au dichlore, dans le raffinage des produits pétroliers, pour régénérer des catalyseurs…
- Électronique : pour la fabrication de SiO2 sur les wafers de silicium. Par exemple, Altis Semiconductor, à Corbeil (91), l’ex-usine IBM, consomme par an 160 000 m3 de O2 de haute pureté.
- Santé : dans l’oxygénothérapie pour l’assistance respiratoire, en réanimation, en anesthésie. La consommation humaine est de 3 000 à 5 000 L d’air par 24 heures. Au repos, la consommation est de 0,2 L.min-1, elle passe à près de 4 L.min-1 lors d’un effort intense. L’homme peut respirer une atmosphère contenant entre 14 % et 75 %, en volume, de dioxygène. En dessous de 7 %, des troubles graves apparaissent, en dessous de 3 %, c’est l’asphyxie. Au-dessus de 75 % les symptômes d’hyperoxie apparaissent et il y a danger de mort. De même, O2 est toxique s’il est respiré à une pression supérieure à 0,17 MPa soit sous 7 m de profondeur sous l’eau. 1 g d’hémoglobine peut fixer 1,34 mL de O2 en donnant de l’oxyhémoglobine.
- Blanchiment de la pâte à papier : le dioxygène est utilisé, après lessivage à la soude (voir le chapitre hydroxyde de sodium), afin d’éliminer une partie (environ la moitié) de la lignine restant dans la cellulose. C’est cette lignine qui est responsable de la couleur jaune de la pâte. Ce traitement, appelé cuisson étendue, permet de réduire les quantités de produits de blanchiment employés (Cl2, ClO2, H2O2, O3).
- Découpage et soudage par flammes oxyacétyléniques.
- Retraitement de déchets chimiques.
- Traitement de l’eau : oxygénation de la Seine en aval de Paris, au pont d’Argenteuil, par injection de plus de 200 000 L/h de O2, afin de créer une zone de refuge pour les poissons, en cas de pollution brutale. Voir le chapitre eau.
Dioxygène liquide
Il est utilisé comme comburant de propulsion spatiale. Le moteur Vulcain du premier étage d’Ariane V utilise 27 t de H2 stocké liquide à 20 K et 132 t de O2 stocké liquide à 91 K. La combustion dure 600 secondes. La poussée (1 120 kN) est obtenue par éjection à grande vitesse du gaz (250 kg/s) produit par la combustion à haute pression (108 bar) et haute température (3 500 K). L’alimentation s’effectue selon un débit de 200 L/s de O2 et 600 L/s de H2, la combustion étant effectuée en excès de H2 afin de protéger de l’oxydation les matériaux de la chambre de combustion.
Les réservoirs du lanceur des navettes spatiales américaines contenaient 1 892 500 L de H2 liquide et 1 324 750 L de O2 liquide. De plus, des moteurs auxiliaires à H2 et O2 fournissaient l’électricité de la navette et servaient à l’allumage des moteurs qui ajustaient la trajectoire de la navette et permettaient de revenir sur terre. Dans ce cas, O2 est à 99,999 % et la quantité utilisée est de l’ordre de 50 t. Dans la navette, O2 permettait également de refroidir les 3 ordinateurs de bord et pouvait être vaporisé pour reconstituer l’air respiratoire.
L’oxygène liquide est également, par évaporation, une source de dioxygène gazeux directement utilisable par la clientèle.
L’oxygène liquide a été également utilisé comme explosif en présence de combustibles divers (paraffine, sciure de bois, noir de fumée…). Par exemple, il a été ainsi utilisé, pour la première fois à grande échelle, lors du percement du tunnel du Simplon.
Bibliographie
- Rapports d’activité et informations de Air Liquide, Direction de la communication, 75 Quai d’Orsay, 75321 Paris Cedex 07.
- Rapports d’activité de Linde, 523 cours du 3ème millénaire – CS10085, 69792 Saint-Priest Cedex.
- Rapports d’activité de Messer, 25 rue Auguste Blanche, 92816 Puteaux Cedex.
- Rapports d’activité d’Air Products, Parc des portes de Paris, 45 Avenue Victor Hugo, 93534 Aubervilliers.
- M. Bernard, Cours de chimie minérale, Dunod, 1990.
Archives
Engrais phosphatés
Données industrielles
Matières premières
La teneur moyenne de l’écorce terrestre est de 0,11 % en phosphore.
Le principal minerai est un phosphate calcique naturel, la fluorapatite phosphocalcique – Ca10(PO4)6F2 – plus ou moins carbonatée avec une teneur moyenne de 26 à 34 % en P2O5 (soit 57 à 74 % en phosphate tricalcique (PTC) – Ca3(PO4)2) pour le minerai marchand.
Les teneurs des minerais de phosphate sont données en P2O5 ou en PTC avec 1 % de P2O5 = 2,19 % de PTC. L’appellation industrielle du phosphate tricalcique est « Bone Phosphate of Lime » (BPL).
Les principaux gisements de phosphate actuellement exploités sont de deux types :
- sédimentaire (75 % des ressources) par précipitation des phosphates au fond de mers peu profondes, processus au cours duquel le plancton joue un rôle important. Les gisements du Maroc et des États-Unis sont de ce type.
- igné (23 % des ressources) par intrusion de magma au sein de roches cristallines. Les gisements de la presqu’île de Kola (Finlande et Russie) et d’Afrique du Sud sont de ce type.
Autres matières premières :
Phosphate alumino calcique : CaO,2Al2O3,P2O5,5H2O (34 % de P2O5) produit au Sénégal et utilisé directement comme engrais après calcination vers 600-700°C.
Matière première nécessaire à la fabrication des engrais phosphatés : le soufre donnant l’acide sulfurique.
Production minière de phosphates
Production minière de phosphates
En milliers de t, en 2024, sur un total de 240 millions de t. Source : USGS
| Chine | 110 000 | Brésil | 5 300 | |
| Maroc | 30 000 | Égypte | 5 000 | |
| États-Unis | 20 000 | Pérou | 5 000 | |
| Russie | 14 000 | Tunisie | 3 300 | |
| Jordanie | 12 000 | Vietnam | 2 600 | |
| Arabie Saoudite | 9 500 | Sénégal | 2 500 |
Le maximum de production aux États-Unis a été de 54,4 millions de t, en 1980.
La seule mine de phosphates en activité dans l’Union européenne, exploitée par Yara, est située en Finlande, à Siilinjärvi. Sa production, en 2020, a été de 995 000 t.
La capacité mondiale de production est, en 2020, de 238 millions de t/an.
Exprimée en P2O5, la production mondiale est, en 2019, de 63,638 millions de t.
Au Maroc, la production est assurée par l’Office Chérifien des Phosphates (OCP), premier producteur mondial de phosphates naturels avec, en 2023, une production marchande de 28,7 millions de t obtenue à partir d’une extraction minière de 30,2 millions de t et des capacités de 47,1 millions de t/an.
- La principale exploitation minière se situe à Khouribga, à 120 km au sud-est de Casablanca. Exploitée initialement, en 1921, par voie souterraine, et depuis 1951, à ciel ouvert avec une capacité de production de 28 millions de t/an et des réserves de 35 milliards de t. Le minerai est acheminé sous forme de pulpe (60 % de minerai – 40 % d’eau) à l’aide d’un minéralduc souterrain de 187 km de long, jusqu’à l’usine de Jorf Lasfar. L’utilisation du pipeline devrait permettre d’augmenter les capacités de production de la mine de Khouribga jusqu’à 38 millions de t/an. En 2023, la production marchande a été de 22,7 millions de t.
- Les sites de Youssoufia, à 230 km au sud de Casablanca, par voie souterraine, et de Benguérir, exploitent le gisement de Gantour qui couvre 2 500 km2 et possèdent une capacité de production de 5 millions de t/an avec des réserves de 31 milliards de t. Le minerai est expédié par voie ferroviaire à l’usine et au port de Safi. En 2022, la production marchande a été de 4,5 millions de t.
- Le site de Boucraâ, à ciel ouvert, situé au Sahara Occidental, avec une capacité de production de 4 millions de t/an, transporte le minerai qui titre 36,15 % de P2O5, à l’aide d’un convoyeur de 102 km de long, jusqu’au port de Laâyoune pour être exporté. En 2023, la production a té de 1,4 million de t.
- Les exportations marocaines ont été, en 2023, de 5,6 millions de t de phosphates naturel, soit une part de marché de 16 %, et les livraisons aux usines de transformation du groupe de 26,4 millions de t.
- Le principal producteur est Mosaic, 2ème producteur mondial, hors Chine, avec, en 2024, 3 mines en activité en Floride, une capacité de production de 14 millions de t/an et une production, en 2024, de 8,9 millions de t de minerai à 28,3 % de P2O5 soit 47 % de la production nord américaine :
- à Four Corners, avec une production, en 2020, de 7,0 millions de t,
- South Fort Meade, avec 3,36 millions de t,
- Wingate, avec 1,27 million de t.
Les réserves prouvées et probables de Mosaic, aux États-Unis, sont de 100 millions de t, à 27,4 % de P2O5.
Par ailleurs, Mosaic possède 75 % de la mine de Miski Mayo, au Pérou, d’une capacité de production de 4,8 millions de t/an et 25 % de celle de la région du Umm Wual destinée à alimenter le complexe de Wa’ad Al Shamal, en joint venture avec Ma’aden, en Arabie Saoudite, d’une capacité de production de 3,5 millions de t/an de produits finis avec, en 2023, une production de 3,1 millions de t.
En janvier 2018 a acquis l’activité engrais de Vale avec 5 mines de phosphates au Brésil avec une capacité de 4,6 millions de t/an et une production, en 2024, de 3,9 millions de t renfermant 34,8 % de P2O5 et 75 % de la mine de Miski Mayo au Pérou, avec une capacité de 4,8 millions de t/an et, en 2023, une production de 4,7 millions de t de minerai renfermant 29,7 % de P2O5.
-
Le deuxième producteur des États-Unis est Nutrien, issu de la fusion, le 1er janvier 2018, entre PotashCorp et Agrium, avec une capacité de production de 7,4 millions de t/an avec une mine en Caroline au Nord, à Aurora, avec, en 2024, une production de 3,99 millions de t à 28,28 % de P2O5 et une mine en Floride, à White Springs, avec 1,19 million de t à 30,62 % de P2O5. Les réserves prouvées et probables sont, début 2018, de 155,3 millions de t à 30,66 % de P2O5.
-
Simplot, exploite la mine de Smoky Canyon dans le Wyoming, avec une capacité de production de 2 millions de t/an et celle de Vernal dans l’Utah.
- Itafos, a acquis auprès d’Agrium, en janvier 2018, la mine de Rasmussen Ridge, dans l’Idaho, avec une capacité de production de 2 millions de t/an et des réserves prouvées et probables de 12,2 millions de t à 26,6 % de P2O5. Par ailleurs exploite, dans l’Idaho, la mine de Lanes Creek et a débuté l’exploitation de la mine d’Arraias, dans l’État de Tocantins, au Brésil.
-
Bayer, après l’acquisition de Monsanto, exploite la mine de Blackfoot Bridge, dans l’Idaho, afin d’alimenter son usine de production de phosphore destiné à produire du trichlorure de phosphore pour synthétiser l’herbicide glyphosate.
En Tunisie, le gisement, découvert en 1885, est situé au nord du chott el Jerid. La Compagnie des Phosphates de Gafsa (CPG) exploite le gisement à l’aide de 8 mines à ciel ouvert avec une capacité de production de 8 millions de t/an de minerai. Une partie du minerai extrait présente une bonne solubilité qui permet une utilisation directe, comme engrais, sans transformation chimique. Toutefois, la plus grande partie du minerai est soit exportée soit transformée en acide phosphorique et engrais phosphatés dans une usine (M’dhilla) proche de l’exploitation minière ou dans des usines côtières à Sfax, Gabès et Skhira. La production qui était de 8,1 millions de t en 2010, a chuté à 2,3 millions de t en 2011, puis est remontée progressivement à 3,73 millions de t en 2019. De même les exportations qui étaient de 700 000 t en 2010 sont devenues quasi nulles en 2016.
Commerce international : en 2024, sur un total de 29,422 millions de t. Exprimé, en P2O5, il porte, en 2019, sur 9,348 millions de t.
Principaux pays exportateurs :
| Jordanie | 7 293 | Togo | 1 293 | |
| Pérou | 4 851 | Afrique du Sud | 1 035 | |
| Maroc | 4 392 | Russie | 793 | |
| Égypte | 3 552 | Liban | 792 | |
| Algérie | 1 481 | Kazakhstan | 696 |
Source : ITC
Les exportations péruviennes sont principalement destinées aux États-Unis à 63 %, au Brésil à 25 %, à l’Argentine à 6 %.
Principaux pays importateurs :
| Inde | 11 124 | Lituanie | 832 | |
| États-Unis | 3 391 | Turquie | 830 | |
| Chine | 2 068 | Belgique | 820 | |
| Indonésie | 1 537 | Serbie | 675 | |
| Brésil | 1 343 | Russie | 589 |
Source : ITC
Les importations de l’Inde proviennent principalement de Jordanie à 45 %, du Maroc à 15 %, d’Égypte à 13 %, du Togo à 11 %, d’Algérie à 6 %.
Réserves minières de phosphates
En millions de t, en 2024, sur un total mondial de 74000 millions de t. Source : USGS
| Maroc | 50 000 | Brésil | 1 600 | |
| Chine | 3 700 | Afrique du Sud | 1 500 | |
| Égypte | 2 800 | Australie | 1 100 | |
| Tunisie | 2 500 | Arabie Saoudite | 1 000 | |
| Algérie | 2 200 | États-Unis | 1 000 |
Source : USGS
Les réserves sont abondantes mais très inégalement réparties.
Remarques :
Les phosphates naturels ont une teneur moyenne de l’ordre de quelques centaines de ppm d’uranium qui peut être récupéré lors de la fabrication de l’acide phosphorique (cela a été le cas aux États-Unis et au Maroc). Parfois, ils peuvent être considérés comme minerais riches en uranium (4 000 ppm d’U pour les phosphates de Bakouma, en République Centre Africaine). En 1980, 12 % de l’uranium mondial provenait du traitement de phosphates.
Les phosphates contiennent aussi, parfois, du cadmium (de 5 à 150 ppm), élément qui pose des problèmes de pollution car cet élément se retrouve d’une part dans le phosphogypse et d’autre part dans les engrais. Les normes de l’Union européenne fixent à moins de 0,75 mg par 1 % de P2O5, la teneur en cadmium dans les engrais.
Situation française :
Pas de production de phosphates naturels. Jusqu’à l’arrêt de l’exploitation du minerai de fer lorrain et la production de scories de déphosphoration à partir de la minette de Lorraine qui contient de 1,5 à 2 % de phosphore, la production était, par exemple en 1995-96 de 92 763 t de scories soit 11 942 t en P2O5.
Les exportations de phosphates naturels, en 2024, sont de 1 676 t à destination de l’Espagne à 58 %, la Belgique à 23 %, l’Autriche à 9 %, la Chine à 8 %.
Les importations de phosphates naturels, en 2024, sont de 126 649 t en provenance principalement à :
- 37 % d’Algérie,
- 28 % d’Égypte,
- 20 % du Maroc,
- 11 % de Tunisie.
Fabrication industrielle
Voir le chapitre consacré à l’acide phosphorique.
Quelques phosphates naturels broyés finement (Sénégal, Tunisie, États-Unis) peuvent être utilisés directement comme engrais sur des sols acides, mais en général, les phosphates naturels doivent subir une attaque acide, principalement sulfurique, pour être assimilés par les plantes.
Engrais simples
Le superphosphate normal (15 à 18 % de P2O5) est obtenu par attaque du phosphate naturel par l’acide sulfurique selon la réaction :
Ca10(PO4)6F2 + 7 H2SO4 + 17 H2O = 3 Ca(H2PO4)2,H2O + 7 CaSO4,2H2O + 2 HF
Il est constitué principalement par un mélange de phosphate monocalcique et de sulfate de calcium. Sa fabrication nécessite environ 710 kg de phosphate naturel à 63 % de PTC et 370 kg de H2SO4 à 100 % pour 1 t de superphosphate. Il est produit et utilisé principalement en Chine, au Brésil et en Inde. Les capacités mondiales de production sont, en 2024, de 9,4 millions de t de P2O5.
Le superphosphate triple (TSP) (46 % de P2O5), est obtenu par attaque du phosphate naturel par l’acide phosphorique selon la réaction :
Ca10(PO4)6F2 + 14 H3PO4 + 10 H2O = 10 Ca(H2PO4)2,H2O + 2 HF
Sa fabrication nécessite la production d’acide phosphorique et consomme 850 kg de H3PO4 à 40 % de P2O5 et 437 kg de phosphate naturel à 63 % de PCT pour 1 t de superphosphate.
La réaction entre le phosphate naturel et les acides sulfurique ou phosphorique dure entre 20 minutes et 1 heure sur une bande transporteuse de grande largeur (jusqu’à 2 m) avançant à la vitesse de quelques cm/s. Les gaz fluorés sont captés et HF éliminé par lavage à l’eau. Après la mise en stock, la réaction se poursuit lentement (mûrissement), pendant plusieurs jours. Les installations industrielles produisent jusqu’à 1500 t/j de superphosphate.
La production mondiale est, en 2022, de 2,071 millions de t de P2O5, dont 79 000 t en Europe de l’Ouest. En 2022, le commerce international a porté sur 1,445 million de t de P2O5.
Le superphosphate concentré (25 % de P2O5) obtenu par attaque sulfurique et phosphorique.
Autres modes de fabrication d’engrais phosphatés simples :
- Thermique : obtenu par traitement, à 1 250°C, d’un mélange de phosphate, Na2CO3, SiO2 : donne CaNaPO4.
- Phosphate dicalcique : (utilisé surtout comme complément dans l’alimentaire animale) obtenu par attaque du phosphate par HCl ou de l’acide phosphorique : donne CaHPO4.
Engrais binaires NP
Les phosphates d’ammonium diammonique (DAP) et monoammonique (MAP) sont obtenus par neutralisation de l’acide phosphorique par l’ammoniac. Les plus courants sont le DAP 18-46-0 (18 % N – 46 % P2O5 – 0 % K2O) et le MAP 11-52-0. Les consommation pour une t de DAP 18-46-0 sont de 145 kg d’ammoniac, 1,91 t de phosphate à 63 % de PTC, 475 kg de soufre et 1,35 t d’acide phosphorique à 40 % de P2O5. Les consommations pour une t de MAP sont de 219 kg d’ammoniac, 1,72 t de phosphate à 63 % de PTC, 475 kg de soufre et 1,175 t d’acide phosphorique à 40 % de P2O5.
Phosphate d’ammonium diammonique (DAP) (NH4)2HPO4 : principale source de P2O5 de l’agriculture mondiale, particulièrement chinoise. La production mondiale est, en 2022, de 15,405 millions de tonnes de P2O5, dont 13 000 t en Europe de l’Ouest. Le commerce international a porté, en 2022, sur 6,707 millions de t de P2O5.
Phosphate d’ammonium monoammonique (MAP) NH4H2PO4 : phosphate solide le plus concentré disponible sur le marché. La production mondiale est, en 2022, de 14,793 millions de tonnes de P2O5, dont 28 000 t en Europe de l’Ouest. Le commerce international a porté, en 2022, sur 5,977 millions de t de P2O5.
Attaque nitrique des phosphates naturels : utilisée en vue d’éviter l’utilisation du soufre, le rejet de phosphogypse et d’obtenir directement un engrais NP. La difficulté est dans une production de nitrate de calcium très hygroscopique qui est utilisé, dans le nord de l’Europe, sur des sols acides et froids comme engrais de démarrage. Ce procédé est utilisé par Yara, en Norvège.
Productions
Production d’engrais phosphatés
En milliers de t de P2O5, en 2022, sur un total mondial de 46,080 millions de t. Source : FAO
| Chine | 12 899 | Arabie Saoudite | 3 320 | |
| Maroc | 5 443 | Brésil | 2 017 | |
| États-Unis | 5 062 | Pakistan | 622 | |
| Inde | 5 008 | Indonésie | 575 | |
| Russie | 4 346 | Vietnam | 539 |
La production de l’Union européenne, en 2022, est de 1,380 million de t de P2O5.
Commerce international :
Principaux pays exportateurs, en 2022, sur un total mondial de 18,645 millions de t de P2O5.
| Maroc | 3 401 | Belgique | 269 | |
| Chine | 3 846 | Pays Bas | 268 | |
| Russie | 3 089 | Tunisie | 259 | |
| États-Unis | 1 806 | Égypte | 215 | |
| Israël | 466 | Lituanie | 122 |
Source : FAO
Principaux pays importateurs, en 2022, sur un total mondial de 19,301 millions de t de P2O5.
| Brésil | 3 906 | Argentine | 531 | |
| Inde | 3 743 | Pakistan | 298 | |
| États-Unis | 926 | France | 276 | |
| Bangladesh | 956 | Turquie | 240 | |
| Australie | 766 | Mexique | 210 |
Source : FAO
Les engrais phosphatés sont de plus en plus fabriqués dans les pays producteurs de minerai.
Ainsi, la production minière du Maroc est de plus en plus valorisée par transformation du phosphate naturel en acide phosphorique et en engrais phosphatés, souvent en collaboration avec de grands pays consommateurs (Inde, Pakistan, Brésil).
- Les minerais du gisement de Gantour sont traités dans le complexe de Safi pour produire 1,6 million de t/an d’acide phosphorique, 0,5 million de t/an de superphosphate triple et 0,4 million de t/an de phosphate d’ammonium.
- Le minerai du gisement de Khouribga est traité sur le site de Jorf-Lasfar pour produire pour l’OCP, 2,7 millions de t/an d’acide phosphorique. Par ailleurs, cette société a créé diverses joints ventures pour produire, sur ce même site, de l’acide phosphorique et des engrais phosphatés :
- avec des sociétés indiennes dans Imacid détenue pour 1/3 par l’OCP, avec 430 000 t de P2O5/an dans de l’acide phosphorique,
- une société pakistanaise dans Pakistan Maroc Phosphore détenue à 50 % par l’OCP, avec 375 000 t de P2O5/an dans de l’acide phosphorique,
- une société brésilienne dans Bunge Maroc Phosphore détenue à 50 % par l’OCP, avec 375 000 t de P2O5/an dans de l’acide phosphorique,
- Emaphos détenue à 1/3 par l’OPC, 1/3 par Prayon (Belgique), 1/3 par CFB (Allemagne), avec 160 000 t/an d’acide phosphorique purifié.
- En 2021, 61 % du chiffre d’affaire a été réalisé par la vente d’engrais, 15 % par celle de minerai de phosphate et 14 % par celle d’acide phosphorique.
En Tunisie : le minerai est traité sur place dans l’usine de M’dhilla pour produire du superphosphate triple, avec 465 000 t/an, ou acheminé par chemin de fer pour être transformé par le Groupe Chimique Tunisien (GCT) :
- à Sfax avec 330 000 t/an de TSP,
- à Skhira avec 375 000 t/an de P2O5 dans de l’acide phosphorique,
- à Gabès avec 470 000 t/an de P2O5 dans de l’acide phosphorique, 1,3 million de t/an de DAP et 120 000 t/an de phosphate dicalcique destiné à l’alimentation animale.
Aux États-Unis, Mosaic, avec 4 usines et 4,5 millions de t/an de P2O5 sous forme d’acide phosphorique détient 58 % des capacités de production d’acide phosphorique du pays. Les usines sont situées en Floride, à Bartow, New Wales, Plant City (temporairement arrêtée) et Riverview et en Louisiane à Uncle Sam qui ne produit que de l’acide phosphorique, les autres usines produisant également divers engrais phosphatés. Par ailleurs, en Louisiane, l’usine de Faustina qui ne produit pas d’acide phosphorique produit divers engrais phosphatés.
Situation française
Voir également le chapitre consacré à l’acide phosphorique.
Arrêt, en 2004, de la dernière usine française de production d’acide phosphorique destiné à la production d’engrais, celle de Grand Quevilly.
Production, en 2019 : 230 831 t comptées en P2O5.
Commerce extérieur : en 2024.
Superphosphate : en t de P2O5.
- Les exportations étaient de 1 885 t avec comme principaux marchés à :
- 41 % la Belgique,
- 38 % l’Irlande,
- 8 % le Royaume Uni
- 7 % l’Espagne.
- Les importations s’élevaient à 107 248 t en provenance principalement à :
- 34 % du Maroc,
- 26 % d’Israël,
- 12 % d’Égypte,
- 9 % des Pays Bas.
Phosphate d’ammonium diammonique : en t de produit.
- Les exportations étaient de 13 306 t avec comme principaux marchés à :
- 93 % l’Espagne,
- 4 % la Belgique.
- Les importations s’élevaient à 334 691 t en provenance principalement à :
- 42 % du Maroc,
- 30 % de Russie,
- 10 % de Lituanie,
- 9 % de Belgique,
- 5 % d’Égypte.
Phosphate d’ammonium monoammonique : en t de produit.
- Les exportations étaient de 8 187 t avec comme principaux marchés à :
- 83 % l’Italie,
- 5 % l’Autriche,
- 4 % le Danemark,
- 4 % la Belgique.
- Les importations s’élevaient à 40 061 t en provenance principalement à :
- 44 % du Maroc,
- 15 % d’Égypte,
- 12 % de Lituanie,
- 8 % de Belgique,
- 7 % d’Espagne.
Consommations : en 2020/21, en milliers de t de P2O5 : 441.
- Engrais phosphatés simples : 117 (34 milliers de t de produit)
- PK : 84 (488 milliers de t de produit)
- DAP-MAP : 133 (288 milliers de t de produit)
- Autres NP et NPK : 107 (988 milliers de t de produit).
Consommation à l’hectare : 16,0 kg de P2O5.
Utilisations
Consommation d’engrais phosphatés par produits
En milliers de t de P2O5, en 2018, sur un total mondial de 45,570 millions de t. Source : IFA
| DAP et MAP | 22 653 | Autres NP | 3 643 | |
| Engrais NPK | 12 160 | Divers autres | 734 | |
| Superphosphate simple | 3 259 | Minerai en application directe | 378 | |
| Superphosphate triple | 2 399 | PK | 343 |
Consommations d’engrais phosphatés par pays
En milliers de t de P2O5, en 2023, sur un total mondial de 44,180 millions de t, en 2022. Source : Nutrien Facts Book
| Chine | 12 097 | Pakistan | 1 257 | |
| Inde | 7 202 | Canada | 1 192 | |
| Brésil | 7 009 | Russie | 1 128 | |
| États-Unis | 4 470 | Bangladesh | 876 | |
| Indonésie | 1 330 | Australie | 874 |
Source : Nutrien Fact book
La consommation de l’Union européenne est, en 2020, de 2,688 millions de t de P2O5.
Bibliographie
- Documents de l’Union des Industries de la Fertilisation, 14 rue de la République, Cedex 99, 92909 Paris La Défense.
- International Fertiliser Association (IFA), 49 av. d’Iéna, 75116 Paris.
- FAO, Viale delle Terme di Caracalla, 00153 Rome, Italie.
- Informations de Fertilizers Europe, Av E. Van Nieuwenhuyse, 4, B-1160, Bruxelles, Belgique.

Commentaires récents