Données physico-chimiques
Données atomiques
| Formule | Numéro atomique | Masse atomique | Configuration électronique | Rayon de Van der Waals |
| He | 2 | 4,003 g.mol-1 | 1s2 | 180 pm |
Données physiques
| Masse volumique | Température de fusion |
Température d’ébullition |
Température critique |
Pression critique |
Température point triple |
Pression point triple |
Conductibilité thermique |
Solubilité dans l’eau |
| à l’état gazeux : 0,1785 g.L-1 |
-272,2°C | -268,93°C | -267,95°C | 227 500 Pa | -270,97°C | 5,04 Pa | 0,146 W.m-1K-1 |
|
Données thermodynamiques
| Hélium gazeux | Hélium en solution aqueuse |
|
|
Données industrielles
L’hélium appartient à la famille des gaz rares qui comprend par ordre de teneur décroissante dans l’atmosphère : l’argon, le néon, l’hélium, le krypton, le xénon et le radon, ce dernier étant radioactif. Ils sont, sauf pour l’hélium et le radon, extraits de l’air. L’argon, avec une teneur dans l’atmosphère de 0,93 % en volume, n’est pas rare.
Teneurs de la croûte terrestre et de l’atmosphère en divers gaz :
| N2 | O2 | H2 | Ar | Ne | He | Kr | Xe | Rn | |
| Teneur de la croûte terrestre, en ppm en masse | 19 | 46.104 | 9.103 | 4.10-2 | 7.10-5 | 3.10-3 | 1,7.10-10 | ||
| % en volume dans l’atmosphère terrestre | 78,09 | 20,95 | 5,0.10-5 | 0,93 | 1,8.10-3 | 5,2.10-4 | 1,0.10-4 | 8,0.10-6 | 6,0.10-18 |
L’hélium est, après l’hydrogène (76 % en masse), le 2e élément le plus répandu de l’univers (23 % en masse). Sur terre, il provient des particules alpha (He2+) produites par la désintégration d’éléments radioactifs comme l’uranium et le thorium ainsi que des rayons cosmiques soit une production annuelle de 3 000 t.
Il est également présent dans des gisements de gaz naturel qui peuvent contenir jusqu’à 7 % d’hélium. Ces gisements sont situés aux États-Unis, au Canada, dans la province du Saskatchewan, en Algérie, en Russie, au Qatar, en Australie, en Azerbaïdjan, au Kazakhstan, en Pologne.
On rencontre de l’hélium dans des eaux thermales, en France et en Allemagne, dans des mines d’anthracite, en Allemagne ainsi que dans le rift africain, en Tanzanie. Dans ce pays une production industrielle est envisagée par la société Helium One. Présent dans du diazote, la teneur en hélium est comprise entre 2,5 et 10,6 % avec des ressources évaluées à 3,9 milliards de m3.
Sources industrielles
L’hélium est principalement récupéré à partir de gisements de gaz naturel ou de dioxyde de carbone pour lesquels trois situations peuvent se présenter :
- L’hélium est récupéré comme sous-produit lors de l’extraction du gaz naturel et du traitement de celui-ci. Pour être économiquement rentable, la teneur du gaz naturel doit être supérieure à 0,3 % d’hélium. C’est le cas du gisement de gaz naturel d’Hugoton Basin, entre les États du Texas, de l’Oklahoma et du Kansas, aux États-Unis, découvert en 1927, qui a une teneur comprise entre 0,3 et 2,7 % d’hélium.
- L’hélium est directement récupéré de gisement gazeux, par exemple de dioxyde de carbone, si sa teneur est également supérieure à 0,3 %. C’est, par exemple, le cas du gisement de Riley Ridge, à La Barge, dans le Wyoming, aux États-Unis, découvert en 1962 par Mobil et exploité depuis 1986 par ExxonMobil, qui contient 66,5 % de dioxyde de carbone, 20,5 % de méthane, 7,4 % de diazote, 5 % de sulfure d’hydrogène, 0,6 % d’hélium. Le dioxyde de carbone extrait est réinjecté dans le gisement afin d’accroître la production de pétrole et de gaz naturel.
- L’hélium est récupéré lors de la liquéfaction du gaz naturel. Dans ce cas, le teneur du gaz naturel en hélium peut être plus faible, par exemple 0,04 % au Qatar. Des unités de récupération de l’hélium sont ainsi associées à des usines de liquéfaction de gaz naturel, en Algérie, au Qatar.
L’hélium peut aussi, marginalement, être récupéré à partir de l’air dans des unités de séparation des gaz de l’air. Lors de la distillation des gaz de l’air, il n’est pas condensé et se retrouve (avec le néon) au sommet de la colonne moyenne pression, avec le diazote (voir le chapitre dioxygène). Sa concentration dans ce gaz brut de néon et d’hélium est de 24 %. La séparation du mélange est réalisée à basse température par condensation du néon, l’hélium restant gazeux. La production est de 1,4 m3 de He par heure dans une unité possédant une capacité de 2 000 t/jour de dioxygène. On peut considérer, dans ce cas, que l’hélium est un coproduit de la production de néon.
Fabrication industrielle
Lorsque l’hélium est présent, dans le gaz naturel, à des teneurs élevées, il est d’abord récupéré sous forme d’un gaz brut contenant de 50 à 70 % d’hélium qui est ensuite raffiné.
- Obtention du gaz brut : l’eau, le dioxyde de carbone, le mercure et le sulfure d’hydrogène sont extraits par absorption dans des solvants ou adsorption puis, les hydrocarbures à poids moléculaire élevé sont fixés sur un lit de charbon actif et enfin, le méthane est extrait par distillation cryogénique. Le gaz brut obtenu contient du diazote comme principale impureté ainsi que du méthane, de l’argon, du néon et du dihydrogène. La teneur de ce dernier doit, pour le système de stockage du gaz brut des États-Unis, être inférieure à 20 ppm.
- Raffinage : le gaz brut est refroidi à une température inférieure à -196°C, afin de condenser le diazote et le méthane restant. Le gaz obtenu contenant environ 90 % d’hélium est brûlé, en présence d’air enrichi en dioxygène, sur catalyseur, pour éliminer le dihydrogène, en formant de l’eau. Enfin, une purification par le procédé PSA (Pressure Swing Adsorption, voir le chapitre diazote) d’adsorption sur charbon actif donne de l’hélium à 99,99 %, la principale impureté résiduelle étant le néon, qui après une distillation cryogénique peut atteindre une teneur de 99,9999 %. La purification à l’aide membranes, par exemple de polyimide, se développe, l’hélium diffusant à travers ces membranes beaucoup plus rapidement que les autres impuretés.
Lorsque l’hélium est récupéré lors de la liquéfaction du gaz naturel, seules les dernières étapes, après la distillation cryogénique du méthane, sont mises en œuvre.
Productions
Production d’hélium
En 2024, en millions de m3, sur un total mondial de 180 millions de m3. Source : USGS
| États-Unis | 81 | Canada | 6 | |
| Qatar | 64 | Chine | 3 | |
| Russie | 17 | Pologne | 3 | |
| Algérie | 11 |
Les productions sont mesurées à 1013,25 hPa et 15°C.
Les capacités mondiales de production sont, en 2016, de 270 millions de m3 dont 160 millions de m3 aux États-Unis. Dans le monde, en 2018, il y a 14 unités de production d’hélium raffiné dont 7 aux États-Unis, 2 au Qatar et en Algérie et une en Australie, Russie et Pologne.
Pays producteurs
États-Unis d’Amérique
En 2023, la production américaine provient pour 68 millions de m3 de l’extraction directe et pour 13 millions de m3 de déstockage du réservoir de Cliffside. Fin 2023, le total stocké dans le réservoir de Cliffside est de 51,5 millions de m3.
Historique de la production industrielle d’hélium aux États-Unis
La première mise en évidence d’hélium dans le gaz naturel a été, en 1903, dans un forage pétrolier à Dexter, dans le Kansas. L’exploitation de l’hélium de l’important gisement de gaz naturel d’Hugoton a permis aux États-Unis de détenir pendant longtemps un quasi monopole de production.
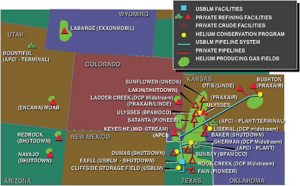 Source : Selling the Nation’s Helium Reserve.
Source : Selling the Nation’s Helium Reserve.
Après une faible utilisation dans des ballons captifs, lors de la première guerre mondiale, puis dans un dirigeable, le C-7 de la marine américaine, en 1921, la production s’est surtout développée pendant la 2ème guerre mondiale pour gonfler les aérostats utilisés par la marine américaine dans la détection de sous-marins pour protéger les convois de navires.
Du fait des besoins militaires, l’État américain a contrôlé depuis 1925 sa production d’hélium, ce contrôle se poursuivant pendant la guerre froide afin d’alimenter les besoins américains pour les fusées de la conquête spatiale et les recherches scientifiques. A cette fin, les producteurs américains de gaz naturel ont été incités, en 1960, à en extraire l’hélium et à le vendre à l’État qui a ainsi constitué une réserve stratégique dans le gisement de Cliffside, situé près d’Amarillo, au Texas. Cette réserve, dénommée Bush Dome Reservoir est alimentée par l’Helium pipeline, long de 425 miles, qui collecte le gaz brut, contenant de 50 à 70 % d’hélium, produit par les 9 usines privées raccordées, représentant 40 % de la demande des États-Unis. Le système mis en place par l’État américain était géré par une agence du département de l’intérieur : le BLM (Bureau of Land Management). La demande ne suivant pas la production, le stockage est interrompu en 1973 puis, à compter de 1996, un processus de privatisation et de vente du gaz accumulé a été enclenché. En juin 2024, le gaz stocké restant, soit environ 50 millions de m3, a été vendu à Messer, avec l’ensemble du « Federal Helium System ». Il a la composition suivante : hydrocarbures : 46 %, hélium : 28 %, diazote : 25 %, dioxyde de carbone : 1 %. Une usine située à Cliffside effectue une première séparation en extrayant les hydrocarbures et en alimentant le pipeline avec de l’hélium brut renfermant 78 % de He, 21 % de N2 et moins de 1 % de CH4. Actuellement, l’Helium pipeline alimente 6 usines privées de purification et commercialisation de l’hélium produit, exploitées par Air Products, Messer, Air Liquide, Matheson et Linde. Par ailleurs, d’autres producteurs commercialisent directement l’hélium extrait de leurs gisement, par exemple ExxonMobil avec son gisement de Riley Ridge qui alimente avec un pipeline de 40 miles, l’usine d’extraction et purification de Shute Creek, près de La Barge, dans le Wyoming avec une production de 39 millions de m3/an.
Qatar
L’hélium est extrait, depuis 2005, du gaz provenant du gisement de North Field contenant 0,04 % de He. Cette première usine d’extraction, d’une capacité de 18,7 millions de m3/an, est située sur le site de Ras Laffan exploité par RasGas, joint venture entre QatarEnergy (70 %) et ExxonMobil (30 %). En 2013, a démarré une nouvelle unité de 38 millions de m3/an, construite par Air Liquide et exploitée par RasGas, l’hélium produit étant destiné pour 50 % de la production à Air Liquide, 30 % à Linde et 20 % à Iwatani Corporation. Une nouvelle unité de production de 12 millions de m3 est en construction.
Algérie
Elle récupère l’hélium lors de la liquéfaction du gaz naturel dans les usines d’Arzew et Skikda. La société Hélios, commune à la Sonatrach (51 %) et à Helaps (49 %, joint venture 50/50 entre Air Liquide et Air Products) possède, depuis 1995, une capacité de production de 16 millions de m3/an dans l’usine d’Arzew, à Béthioua, près d’Oran. Helison Production, société commune entre Linde (51 %) et la Sonatrach (49 %) extrait, depuis 2007, l’hélium du gaz naturel de Hassi R’Mel, liquéfié à Skikda, qui contient 5,5 % de diazote et 0,18 % d’hélium. La capacité de production de 16 millions de m3 est actuellement limitée à 8 millions de m3 après les problèmes survenus à l’usine de liquéfaction.
Australie
Dans les Territoire du Nord, Linde, exploite, depuis 2010, avec une capacité de production de 4,2 millions de m3/an, l’usine de Wickham Point, approvisionnée par le gaz brut (contenant 3 % d’hélium) provenant de l’usine de liquéfaction de gaz naturel exploitée par ConocoPhillips, à Darwin. Le gaz naturel est extrait du gisement de Bayu-Undan situé en mer, entre l’Australie et le Timor Oriental, et acheminé à l’usine de Darwin par un pipeline de 502 km. En 2023, la production a cessé.
Russie
La production, réalisée à partir du gaz naturel d’Orenbourg, depuis 1977, est contrôlée par Gazprom. En 2020, la production a été de 4,47 millions de m3. Gazprom construit, à Svobodny, dans la région du fleuve Amour, une usine de production de 60 millions de m3/an à partir de l’exploitation du gaz naturel du gisement de Chayandinskoye. La première ligne de production est opérationnelle depuis fin 2021, la troisième et dernière le sera en 2025.
Pologne
L’usine d’Odolanow, est exploitée, depuis 1977, par Polish Oil and Gas Company (PGNiG) qui produit l’hélium à partir d’un gaz naturel contenant de 0,08 à 0,45 % de He. En 2020, la production est de 2,9 millions de m3.
Canada
La société North American Helium a débuté, en juillet 2020, une production d’hélium, associé à du diazote, sur le gisement de Cypress, dans le sud-ouest de la province du Saskatchewan, qui devrait se poursuivre sur celui de Battle Creek dans cette même province.
Weil Group, développe une production dans la même région sur le gisement de Mankota.
Afrique du Sud
La société Renergen a construit une usine de liquéfaction de gaz naturel et de récupération de l’hélium contenu, dans la province du Free State, à 250 km au sud-ouest de Johannesburg. Les réserves prouvées et probables sont de 97 millions de m3. La teneur du gaz extrait est de 3,4 % d’hélium. La production est de 350 kg/jour. TotalEnergies commercialise le gaz naturel et Linde l’hélium.
Commerce international
En 2024, les exportations des États-Unis ont été de 42 millions de m3 pour des importations de 12 millions de m3 provenant principalement du Qatar et du Canada.
En 2017, les importations chinoises ont été de 20,3 millions de m3, à 51 % du Qatar, 36 % des États-Unis, 11 % d’Australie. Celles du Japon, de 10,3 millions de t, à 75 % des États-Unis, 25 % du Qatar.
Réserves
En 2024, les réserves inventoriées sont les suivantes, sur un total estimé de 41 milliards de m3 :
| États-Unis | 8 500 | Russie | 1 700 | |
| Algérie | 1 800 | Pologne | 24 |
Des réserves, non estimées, sont également présentes au Qatar, au Canada et en Chine.
En 2016, la société Helium One a annoncé la découverte d’un important gisement, Rukwa, dans la vallée du Rift, en Tanzanie, avec des ressources de 3,9 milliards de m3.
Les réserves des États-Unis se répartissent de la façon suivante :
| Riley Ridge (Wyoming) | 1 391 | Rands Butte (Wyoming) | 482 | |
| Hugoton stockage | 750 | St John’s (Arizona) | 394 | |
| Hugoton hors stockage | 581 | Autres | 737 |
Source : Selling the Nation’s Helium Reserve.
Producteurs et distributeurs
Le principal producteur mondial est ExxonMobil avec son gisement de Riley Ridge qui alimente avec un pipeline de 40 miles, l’usine d’extraction et purification de Shute Creek, près de La Barge, dans le Wyoming, qui a produit, en 2006, 9,5 millions de m3 de He. Le gaz produit est vendu à Airgas (société acquise par Air Liquide, en mai 2016), Air Liquide, Matheson, Air Products et Linde. ExxonMobil est également associé dans l’extraction de l’hélium au Qatar.
Air Products et Matheson exploitent, depuis 2014, une usine de production d’hélium, près de Big Piney, dans le Wyoming, à partir du gaz du gisement de Riley Ridge fourni par Denbury.
Principaux distributeurs mondiaux d’hélium :
- Air Liquide, s’approvisionne auprès d’ExxonMobil aux États-Unis et RasGaz au Qatar. Par ailleurs, Air Liquide est partenaire de la société Hélios récupérant l’hélium du gaz naturel liquéfié à Arzew, en Algérie.
- Air Products, à Hansford County (Texas), Liberal (Kansas) et Big Piney (Wyoming), aux États-Unis et Arzew, en Algérie.
- Linde, à Otis, Bushton et Ulysses (Kansas), aux États-Unis et Skikda, en Algérie. S’approvisionne également, aux États-Unis, auprès d’ExxonMobil. En mars 2019, a acquis Praxair.
- Taiyo Nippon Sanso, avec, aux États-Unis, sa filiale Matheson associée à Air Products à Big Piney, dans le Wyoming.
Transport
Le gaz est transporté liquéfié à 4 K.
Situation française
En 2024.
Des eaux thermales renferment de l’hélium, non exploité, avec des teneurs pouvant atteindre 10 % à Santenay (21), 1 % à Néris (03) et des débits de 17 à 34 m3/an.
Dans les années 1970, Gaz de France, lors de l’élimination du diazote contenu dans le gaz naturel hollandais a coproduit de l’hélium dans son usine d’Alfortville (94). Cette production a cessé avec l’arrivée du gaz naturel russe.
Air Liquide, dans son usine du Blanc-Mesnil (93), de séparation des gaz de l’air, possède une capacité de production de 18 m3/h.
Prospection : en 2019, la société 45-8 Energy a déposé une demande de Permis Exclusif de Recherche sur une zone de 251 km2, dans le sud du département de la Nièvre, autour de la commune de Saint-Parize-le-Châtel. En septembre 2024, a été inaugurée une unité pilote de production d’hélium au hameau de Fonts-Bouillants.
Les exportations françaises étaient de 6,309 millions de m3 avec comme principaux marchés à :
- 31 % l’Allemagne,
- 15 % la Belgique,
- 11 % l’Espagne,
- 10 % l’Irlande,
- 8 % la Hongrie,
- 8 % la Pologne.
Les importations françaises s’élevaient à 5,952 millions de m3 en provenance principalement à :
- 86 % d’Algérie,
- 6 % d’Allemagne,
- 3 % des États-Unis,
- 3 % de Belgique.
Utilisations
Consommation
En 2018, la consommation dans le monde est de 160 millions de m3 dont 59 millions de m3 aux États-Unis, en 2023.
Secteurs d’utilisation de l’hélium
En 2021, dans le monde. Source : Kornbluth Consulting
| Électronique | 25 % | Laboratoires | 6 % | |
| IRM, cryogénie | 23 % | Détection de fuites | 6 % | |
| Remplissage de ballons | 15 % | Pressurisation et purges | 5 % | |
| Soudage | 9 % | Mélanges respiratoires | 3 % |
Source : Kornbluth consulting
En 2024, aux États-Unis, l’IRM représente 17 % des utilisations, le remplissage de ballons, 18 %, le soudage, 8 %.
Les raisons de son utilisation dans ces secteurs s’expliquent, par exemple, par :
- Sa faible température d’ébullition (4,21 K et jusqu’à 0,7 K en réduisant la pression), le fait utiliser en cryogénie lorsque de très basses températures sont désirées : aimants supraconducteurs, utilisés en imagerie médicale (scanner IRM), ou dans les accélérateurs de particules. Le LHC (Grand Collisionneur de Hadrons) du CERN, près de Genève, anneau de 26,659 km, comporte 9 300 aimants pré-refroidis à -193,2°C à l’aide de 10 080 t d’azote liquide puis à -271,3°C avec 120 t d’hélium liquide.
Les scanners d’IRM qui demandaient jusqu’à 2000 litres d’hélium pour fonctionner, avec des pertes de 30 à 60 mL/h, n’utilisent, par exemple pour un appareil Philips que 7 L. L’hélium est en grande partie recyclé et liquéfié à nouveau. - C’est le seul gaz inerte et ininflammable qui reste gazeux à la température du dihydrogène liquide. Pour cette raison il est utilisé pour purger les réservoirs à hydrogène liquide ainsi que pour pressuriser l’oxygène liquide, employés comme propergols du moteur Vulcain de la fusée Ariane 5. En 1970, la moitié de la production des États-Unis (18,3 millions de m3) était utilisée par la NASA. Actuellement, la consommation de la NASA est de 2 à 2,4 millions de m3/an. En France, il est principalement utilisé pour les essais des moteurs d’Ariane par ArianeGroup.
- Sa faible densité par rapport à l’air (0,138) lui permet d’être utilisé dans les dirigeables (en remplacement de H2) et surtout dans les ballons météorologiques. Cette dernière utilisation consomme 4 millions de m3/an. Il a été employé dans le remplissage de pneus d’avions (Concorde). Diffusant très rapidement, il est utilisé pour détecter les fuites des installations sous vide, à l’aide d’un spectromètre de masse.
- Gaz inerte, il est utilisé comme atmosphère protectrice dans le soudage à l’arc des métaux, à la place de l’argon, meilleur marché, lorsque les métaux à souder sont bons conducteurs de la chaleur, comme l’aluminium et le cuivre. Il est employé également en métallurgie du tungstène et du zirconium, ainsi que lors de la croissance des monocristaux de silicium et de germanium.
- Du fait de sa faible solubilité (il est moins soluble que N2) dans les solutions aqueuses et en particulier le sang, il remplace le diazote (N2) dans le gaz de respiration des plongeurs sous-marins et permet ainsi d’éviter les embolies gazeuses par dégagement de N2 dans les artères lors de la décompression des plongeurs. Par exemple, la composition : 50 % He, 49 % H2, 0,8 % O2, est utilisée. Par ailleurs, l’hélium n’est pas narcotique, contrairement au diazote, et permet d’éviter l’ivresse des profondeurs. En mélange avec 20 % de O2, il est utilisé comme atmosphère de respiration lors d’œdèmes du poumon. Le respiration de faibles quantités d’hélium durant des durées brèves entraîne une modification du timbre de la voix.
- Utilisations diverses : dans les lasers à gaz, chromatographie, en phase gazeuse, comme gaz de souffleries hypersoniques, dans des chambres à bulles, dans le cryopompage…
Bibliographie
- Encyclopédie des gaz, Elsevier, L’Air Liquide, 1976.
- Documents et informations des producteurs de gaz de l’air (voir le chapitre dioxygène).
- S. T. Anderson, « Economics, Helium, and the U.S. Federal Helium Reserve : summary and outlook« , Natural Resources Research, vol. 27, n°4, octobre 2018.
- E. Grynia et P.J. Griffin, « Helium in natural gas – Occurrence and production« , J. Natural Gas Eng., vol 1, n°2, déc. 2016.
- Selling the Nation’s Helium Reserve, The National Academies Press, Washington, 2010.
- Kornbluth Helium Consulting.
- H. Elsner, « Nobles gases – supply really critical ?« , DERA Rohstoffinformationen, oct. 2018.
- « Helium – Macro View Update » Edison Investment Research, février 2019.
Commentaires récents