Données physico-chimiques
Données atomiques
| Formule | Masse molaire | Minéral | Structure cristalline |
| CaSO4,½H2O | 145,15 g.mol-1 | bassanite | monoclinique, de paramètres a = 0,481 nm, b = 0,693 nm, c = 1,267 nm et angle bêta = 90,27° |
Données physiques
| Masse volumique | Déshydratation | Solubilité dans l’eau |
| 2,63 g.cm-3 | se transforme en anhydrite à 163°C | à 20°C : 0,88 g/100 g d’eau |
Données thermodynamiques
Hémihydrate cristallisé (bassanite) :
- Enthalpie molaire standard de formation à 298,15 K : -1 575,2 kJ.mol-1
- Enthalpie libre molaire standard de formation à 298,15 K : -1 436,4 kJ.mol-1
- Entropie molaire standard à 298,15 K : S° = 134,4 J.K-1mol-1
- Capacité thermique molaire sous pression constante à 298,15 K : Cp° = 124,3 J.K-1mol-1
Données industrielles
Matières premières
Gypse naturel, synthétique ou recyclé, voir les chapitres sulfate de calcium et gypse.
Fabrication industrielle
Quelle que soit l’origine du gypse, naturel, synthétique ou recyclé, une déshydratation partielle, par chauffage, donne de l’hémihydrate de calcium selon la réaction suivante, à 150°C :
CaSO4,2H2O = CaSO4,1/2H2O + 3/2 H2O
Un chauffage à plus haute température, 290°C, donne de l’anhydrite CaSO4, sulfate complètement déshydraté, appelé « surcuit » par la profession. Un chauffage à plus de 700°C, donne une anhydrite très peu réactive à l’eau, appelée « plâtre cuit à mort ».
Procédés utilisées : 2 types.
- Le procédé par voie sèche, qui est de très loin le plus utilisé, est réalisé à la pression atmosphérique. Il donne, vers 140-170°C, de l’hémihydrate bêta et par chauffage vers 400-600°C, de l’anhydrite (CaSO4). Le chauffage est effectué, en général, dans des fours rotatifs, de 1 à 2,5 m de diamètre et 10 à 30 m de longueur. Les fours sont munis intérieurement de pales permettant le brassage de la charge. Ils fonctionnent à température constante et donnent soit de l’hémihydrate soit de l’anhydrite en fonction de la température de chauffage choisie, le mélange éventuel étant effectué par la suite. Les capacités de production varient de 5 à 30 t à l’heure.
- Le procédé par voie humide s’effectue sous pression saturante de vapeur d’eau, dans des autoclaves, sous 2 à 7 bar, pendant quelques heures. Il donne de l’hémihydrate alpha utilisé pour des plâtres spéciaux et pour les moulages dentaires. La résistance mécanique de l’hémihydrate alpha est nettement plus importante que celle de l’hémihydrate bêta mais les coûts de production sont beaucoup plus élevés. En conséquence, la production annuelle est faible, de l’ordre de quelques dizaines de milliers de t/an, en France, par comparaison à celle du plâtre obtenu par voir sèche (quelques millions de t/an).
La prise du plâtre
Lors d’un ajout d’eau, l’hémihydrate et l’anhydrite se dissolvent, puis CaSO4,2 H2O précipite : c’est la prise du plâtre.
CaSO4,1/2H2O + 3/2 H2O = CaSO4,2H2O
Le plâtre fait prise du fait de la différence de solubilité entre l’hémihydrate et de dihydrate (le gypse). La solubilité de l’hémihydrate est, à 20°C, de 9 g.L-1, alors que celle du gypse est de 2 g.L-1. En conséquence, en présence d’eau, l’hémihydrate passe en solution, le dihydrate se forme en fixant une partie de l’eau de la solution, la solution devient sursaturée en sulfate qui précipite. Il se reforme ainsi du gypse matière première du plâtre. En 30 minutes environ, 95 % de l’hémihydrate se transforme en dihydrate et il faut moins de 2 heures pour que la réaction soit totale.
La quantité théorique d’eau est de 36 g d’eau pour 145 g d’hémihydrate mais dans la pratique, afin d’avoir une pâte facilement moulable, la quantité ajoutée est de 4 à 5 fois plus importante.
Afin de moduler la vitesse de prise divers ajouts peuvent être effectués.
- Des accélérateurs, particulièrement utilisés dans l’élaboration de produits préfabriqués, permettent de diminuer le temps de prise. Le gypse finement broyé (provenant par exemple du recyclage de chutes de fabrication) permet d’apporter de nombreux germes de cristallisation. L’ajout d’ions sulfate permet également d’accélérer la prise.
- Les principaux retardateurs de prise sont des phosphates alcalins, des acides organiques et leurs sels (par exemple l’acide citrique et les citrates).
Productions
En 2018, la production mondiale est d’environ 100 millions de t, dont, en 2021, 19 millions de t aux États-Unis.
Commerce international : en 2024.
Principaux pays exportateurs, sur un total mondial de 4,370 millions de t :
| Allemagne | 724 | Maroc | 236 | |
| Turquie | 478 | Espagne | 223 | |
| Thaïlande | 436 | Belgique | 190 | |
| France | 314 | Émirats Arabes Unis | 146 | |
| Iran | 307 | Oman | 142 |
Source : ITC
Les exportation allemandes sont destinées principalement à 25 % à la Belgique, 19 % aux Pays Bas, 15 % à la Suède, 14 % à la Suisse, 5 % à la Pologne.
Principaux pays importateurs, sur un total mondial de 5,088 millions de t :
| Royaume Uni | 627 | Norvège | 251 | |
| Corée du Sud | 540 | Pays Bas | 146 | |
| Inde | 501 | Géorgie | 145 | |
| Belgique | 468 | Malaisie | 113 | |
| Portugal | 312 | Suisse | 109 |
Source : ITC
Les importations du Royaume Uni proviennent principalement, à 87 % d’Espagne, 5 % d’Allemagne, 4 % d’irlande.
Produits en plâtre
Poudre : le plâtre utilisé en construction, appelé plâtre de Paris, est un mélange. Il est principalement constitué d’hémihydrate bêta (CaSO4,½H2O, de 60 à 80 %) et d’anhydrite (CaSO4), les autres composés présents provenant d’impuretés contenues initialement dans le gypse. Il est obtenu par le procédé par voie sèche. Les propriétés du plâtre (donc ses utilisations) dépendent, en grande partie, de sa composition en hémihydrate et en anhydrite. Exemple de composition de plâtre destiné à la réalisation d’enduits :
| CaSO4,½H2O | CaSO4 | CaCO3 | MgCO3 | Argile et silice | Adjuvants |
| 72 % | 18 % | 7 % | 1 % | 2 % | < 1 % |
Le plâtre utilisé pour élaborer des produits préfabriqués (carreaux, plaques…) est généralement de l’hémihydrate bêta.
Carreaux : ils ont généralement une épaisseur comprise entre 4 et 10 cm pour des dimensions de 66 x 50 cm. Le plâtre est versé sur l’eau et après un gâchage de quelques dizaines de secondes, le plâtre est coulé dans des moules verticaux en acier, à fond mobile. Le démoulage a lieu après 7 à 10 minutes par montée du fond qui ainsi extrude le carreau en lui donnant une finition de surface particulièrement lisse. Un séchage est réalisé, à l’air chaud, dans des séchoirs tunnels pendant 20 à 35 heures. Le coût du séchage représente environ 25 % du prix de revient du produit fini.
Plaques : elles ont généralement une épaisseur comprise entre 9,5 et 15 mm pour des dimensions de 1,2 x 2,5 m. La production se déroule en continu sur un tapis à une vitesse comprise entre 60 et 160 m/min. Après mélange (avec un rapport massique eau/plâtre de 80 à 90 %, un ajout d’amidon pour assurer l’adhérence avec le carton et un accélérateur de prise, en général du gypse finement broyé) et gâchage, le plâtre est coulé entre 2 feuilles continues de carton recyclé, l’ensemble étant ensuite laminé à l’épaisseur souhaitée par deux cylindres puis coupé en bout de chaîne, la prise étant terminée. Les plaques sont enfin séchées pendant environ 45 minutes. La longueur d’une chaîne de fabrication est de 350 à 500 m avec des consommations qui peuvent atteindre 200 000 t/an de gypse et 10 000 t/an de carton pour des capacités annuelles de production de 20 millions de m2 de plaques. En 2020, la capacité moyenne de production d’une usine est de 32 millions de m2/an.
Les plaques ont été inventées, en 1894, aux États-Unis, par Augustine Sackett, où elles sont appelées « plasterboard » ou « wallboard ». Au Québec, elles sont appelées « cloisons sèches ».
Les coûts de productions sont répartis, par exemple pour Siniat, entre le papier, 25 %, l’énergie, 25 % et le gypse, 10 %.
Productions de plaques : en 2025, en capacités de production, avec un total mondial de 15,2 milliards de m2/an.
| Chine | 4 151 | Corée du Sud | 430 | |
| États-Unis | 3 681 | Allemagne | 348 | |
| Japon | 775 | Canada | 305 | |
| Russie | 483 | Turquie | 300 | |
| Royaume Uni | 454 | Thaïlande | 276 |
Source : Global Gypsum magazine, juillet 2025
En 2025, dans le monde, il y a 455 usines, dont 96 en Chine, 61 aux États-Unis, 20 au Japon, 16 en Russie.
Producteurs de plaques : capacités de production, en 2025.
| BNBM (Chine) | 3,571 | Yoshino Gypsum (Japon) | 0,631 | |
| Knauf (Allemagne) | 3,283 | Georgia Pacific (États-Unis) | 0,551 | |
| Saint Gobain (France) | 2,555 | American Gypsum (États-Unis) | 0,365 | |
| National Gypsum (États-Unis) | 0,825 | Knauf Russie | 0,320 | |
| Etex (Belgique) | 0,751 | KCC (Corée du Sud) | 0,263 |
Source : Global Gypsum Magazine, juillet 2025
- Knauf (Allemagne) : 96 usines dans le monde, avec, en 2025, une capacité de production de 3,283 milliards de m2/an, après l’acquisition, en avril 2019, de US Gypsum, aux États-Unis avec 15 usines de production de plaques aux États-Unis, 3 au Mexique et 2 au Canada. C’est le principal producteurs aux États-Unis avec 24,5 % des capacités de production, devant National Gypsum qui détient 23 % des capacités, Georgia Pacific 16 %, Saint-Gobain 13 %, Eagle Materials 10 %, Continental 10 % et PABCO 4 %. En 2018, les carrières en exploitation du groupe fournissaient 53 % de la consommation des usines de plâtre, le désulfogypse acheté aux centrales thermiques, 39 % et le gypse naturel acheté 8 %. Par ailleurs US Gypsum, était partie prenant dans une joint venture, USG Boral, 50/50 avec le groupe australien Boral, avec 23 lignes de fabrication de plaques, en Asie et Océanie, avec une part de capacité de production de 359 millions de m2/an. En 2021, Knauk a acquis la totalité de USG Boral.
- Le groupe chinois BNBM (Beijing New Building Material) possède une capacité de production de 3,571 milliards de m2/an, soit 88 % des capacités totales du pays avec 80 usines de production.
- Saint Gobain (France) : la production est assurée en France par la filiale Placoplâtre (voir plus loin pour les usines françaises). En Amérique du Nord, la production est assurée par la filiale CertainTeed Gypsum et dans le monde par diverses autres filiales : Gyproc, Rigips, British Gypsum… En 2020, a acquis, aux États-Unis, la société Continental Building Products, qui avait regroupé les activités de Plâtre Lafarge, en Amérique du Nord. En 2025, la capacité de production est de 2,555 milliards de m2/an dans 72 usines.
- National Gypsum (États-Unis) : 18 usines de production aux États-Unis, avec une capacité de production de 825 millions de m2/an.
- Siniat, filiale du groupe belge Etex, a acheté, fin 2011, les activités du groupe Lafarge dans le gypse et le plâtre, en Europe et Amérique Latine (voir plus loin pour les usines françaises). Les capacités de production sont de 751 millions de m2/an dans 25 usines.
- Georgia Pacific (États-Unis) : 13 usines de production, avec une capacité de production de 551 millions de m2/an.
- Yoshino Gypsum Co (Japon), avec 16 usines au Japon et une capacité annuelle de production de 631 millions de m2 de plaques, détient 81 % du marché japonais.
- Par ailleurs les activités de Plâtres Lafarge dans d’autres régions ont évolué de la façon suivante :
- Les activités de Plâtres Lafarge en Asie, c’est-à-dire 50 % de la joint venture avec le groupe australien Boral, ont été reprises par ce dernier, fin 2011.
- Les activés de Plâtres Lafarge en Australie ont été, fin 2011, vendues au groupe Knauf.
- Les activités de Plâtre Lafarge, en Amérique du Nord, ont été vendues mi-2013, pour former le groupe Continental Building Products, avec en particulier, aux États-Unis, 3 usines de fabrication de plaques de plâtre, à Silver Grove dans le Kentucky, Palatka en Floride et Buchanan dans l’État de New-York. La production est réalisée exclusivement à l’aide de gypse de désulfuration, avec, en 2017, une capacité de production de 307 millions de m2/an et une production de 248 millions de m2. En 2020, cette activité a été acquise par Saint-Gobain.
Lafarge poursuit son activité dans le gypse et le plâtre en Algérie, Maroc et Turquie.
Propriétés du plâtre
Lors du séchage du plâtre, naturel ou en usine, le départ de l’eau s’accompagne de l’apparition d’une porosité qui confère au plâtre des qualités d’isolation thermique et phonique. Par ailleurs, la présence de cette porosité permet de réguler l’hygrométrie des locaux.
C’est un matériau résistant au feu. Il est classé A1, c’est-à-dire incombustible. D’autre part, du fait de sa porosité, il est mauvais conducteur de la chaleur et surtout, lors d’un incendie, il libère de l’eau (l’eau de constitution du gypse), en se déshydratant par une réaction de plus endothermique (qui absorbe de la chaleur). Par kilogramme de plâtre, la consommation d’énergie est de 711 kJ pour déshydrater et 544 kJ pour vaporiser l’eau libérée. Tant qu’il reste de l’eau à vaporiser, la température du matériau reste constante à 100°C. Enfin, les transformations subies ne génèrent aucun gaz toxique ni combustible.
Situation française
Production
Gypse et anhydrite, en 2021 : 3,371 millions de t dont 614 000 t utilisées, en 2016, dans les cimenteries.
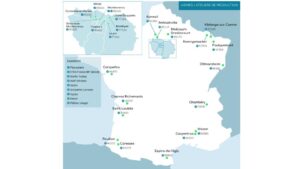
Carte des usines de production de plâtre et d’anhydrite : document du Syndicat National des Industries du plâtre.
Commerce extérieur
Exportations, en 2024 :
- Plaques : 69 799 t (6,632 millions de m2) vers l’Espagne à 31 %, le Royaume Uni à 26 %, la Belgique à 18 %, l’Italie à 7 %, la Nouvelle Calédonie à 4 %.
- Carreaux : 15 067 t (911 534 m2) vers la Belgique à 57 %, l’Australie à 6 %, le Brésil à 5 %, l’Espagne à 5 %.
- Plâtre de construction : 314 491 t vers la Belgique à 64 %, l’Espagne à 9 %, les Pays Bas à 9 %, le Portugal à 8 %.
Importations, en 2024 :
- Plaques : 325 021 t (51,904 millions de m2) d’Espagne à 39 %, de Belgique à 39 %, d’Italie à 11 %, d’Allemagne à 7 %.
- Carreaux : 66 198 t (9,930 millions de m2) d’Espagne à 71 %, d’Allemagne à 11 %, d’Italie à 5 %.
- Plâtre de construction : 62 720 t d’Espagne à 50 %, d’Allemagne à 35 %, de Belgique à 6 %.
Producteurs
3 groupes assurent l’essentiel de la production.
- Siniat, filiale du groupe belge Etex, avec des usines de plaques à Auneuil (60) : 38 millions de m2/an, Carpentras (84), Saint Loubès (33) avec 35 millions de m2/an, Ottmarsheim (68), des usines de plâtre en poudre au Pin (77), Mazan (84), Carresse (64) et des produits en plâtre à Mériel (95) avec 150 000 t/an.
- Placoplâtre, filiale de Saint-Gobain, avec des usines de plaques à Vaujours (93) avec 72 millions de m2/an, Chambéry (73) avec 40 000 m2/an et Cognac (16) avec 33 millions de m2/an, des usines de carreaux et de poudre à Cormeilles (95) et Vaujours (93).
- Plâtres Knauf, filiale française du groupe Knauf avec une usine de plaques de plâtre à Saint-Soupplets (77), avec une production de 45 millions de m2/an de plaques et une consommation de gypse de 450 000 t/an.
Utilisations
Consommations de plaques : 2,6 milliards de m2 de plaques, en 2021, aux États-Unis, 1,6 milliard de m2/an de plaques, en Europe, plus de 300 millions de m2/an de plaques, en France.
Autres utilisations :
Une autre utilisation importante est la fabrication de moules dans l’industrie céramique par exemple pour élaborer des pièces en série : faïences, porcelaines, grès, céramiques sanitaires…
Des mortiers à base de plâtre (sous forme d’anhydrite) et de sable sont utilisés pour réaliser des sols intérieurs de locaux.
Le stuc est un plâtre additionné d’ajouts chimiques et de poudre de pierre, il est destiné à imiter le marbre. Le staff est un plâtre armé de fibres végétales, de fibres de verre ou d’autres matériaux, il est utilisé pour confectionner des plaques pour plafond, des rosaces, des corniches… et est concurrencé par le polyuréthane.
Bibliographie
- Union Nationale des Industries de Carrière et Matériaux de Construction (UNICEM), 3 rue Alfred Roll, 75849 Paris Cedex 17.
- Les Industries du Plâtre, 3 rue Alfred Roll, 75017 Paris.
- Global Gypsum Magazine, juillet 2025.
- Eurogypsum, Rue de la Presse, 4, B-1000, Bruxelles, Belgique.
- M. Nolhier, Construire en plâtre, L’Harmattan, 1986.
- J-L. Vignes, H. Essaddam, D. Daligand, « Une vie de plâtre« , BUP, n°790-91, janvier-février 1997.
Archives
Commentaires récents