L’eau de Javel est une solution aqueuse d’hypochlorite et de chlorure de sodium, en présence d’un excès d’hydroxyde de sodium. Sa composition varie en fonction du pH d’utilisation et du temps écoulé depuis sa fabrication. Son principe actif est, selon le pH, l’ion hypochlorite ClO–, l’acide hypochloreux HClO ou le dichlore Cl2 en solution. Elle est utilisée pour son action en désinfection (HClO est bactéricide, fongicide, virucide et sporicide) et son pouvoir blanchissant.
Données industrielles
L’eau de Javel est une solution aqueuse d’hypochlorite et de chlorure de sodium, en présence d’un excès d’hydroxyde de sodium. Sa composition varie en fonction du pH d’utilisation et du temps écoulé depuis sa fabrication. En fonction de sa concentration elle se présente sous forme de concentré de Javel ou d’eau de Javel proprement dite. Son principe actif est, selon le pH, l’ion hypochlorite ClO–, l’acide hypochloreux HClO ou le dichlore Cl2 en solution.
Fabrication industrielle
En général, par réaction directe entre le dichlore et l’hydroxyde de sodium eux mêmes produits par électrolyse de NaCl :
Cl2 + 2 (Na+ + OH–) = (Na+ + ClO–) + (Na+ + Cl–) + H2O ΔrH°298 = -103 kJ/mole.
La réaction est fortement exothermique et la température ne doit pas dépasser 40°C afin de limiter la dismutation des ions hypochlorites en ions chlorates et chlorures. En conséquence, le milieu réactionnel est énergiquement refroidi. Les installations sont en PVC (cuves, canalisations) et en titane (pompes, échangeurs thermiques).
Le procédé standard consiste à dissoudre le dichlore dans une solution aqueuse de soude à 20 %. On obtient alors une eau de Javel à 13 % de chlore actif.
Le procédé « haut titre » mis au point par Arkema consiste à dissoudre le dichlore dans une solution de soude à 50 %. L’eau de Javel obtenue titre de 24 à 26 % de chlore actif. Lors de la dissolution, environ la moitié du chlorure de sodium formé précipite et est ainsi éliminé. Des solutions de concentrations plus faibles sont ensuite préparées par dilution.
- Sur des sites industriels d’utilisation de l’eau de Javel, des unités de production, en général de petite taille, fonctionnent. L’eau de Javel est obtenue directement par électrolyse de NaCl en solution, dans des cellules ne comportant pas de séparation entre les compartiments anodiques et cathodiques. L’eau de Javel produite est, en général, de faible concentration (< 1 % de chlore actif).
- De l’eau de Javel diluée (0,1 à 0,3 % de chlore actif) est également préparée par électrolyse d’eau de mer. Cette production est effectuée dans des centrales nucléaires utilisant dans leur circuit de refroidissement de l’eau de mer (Gravelines en France) et dans les usines de dessalement d’eau de mer.
- De l’eau de Javel est également obtenue comme sous produit de l’électrolyse de NaCl lors de la production de Cl2 et NaOH. A la sortie des cuves d’électrolyse, les solutions appauvries en NaCl contiennent du dichlore dissous. Avant d’être recyclées, ces solutions sont déchlorées, le dichlore produit traité par NaOH donne de l’eau de Javel.
Conditionnement : à 2,6 % ou 3,6 % de chlore actif pour l’eau de Javel et à 9,6 % de chlore actif pour les concentrés de Javel dans des emballages en PVC ou polyéthylène.
Définitions du titre d’une eau de Javel :
Le degré chlorométrique (°Chl) : donne le pouvoir oxydant d’un litre d’eau de Javel, à 20°C, exprimé en litres de dichlore gazeux sous 1 bar et à 0°C. Il correspond au dichlore gazeux utilisé pour fabriquer l’eau de Javel. Cette définition était utilisée essentiellement dans les pays francophones.
Le % de chlore actif : au niveau européen, a été retenue cette définition, anglo-saxonne, du titre d’une eau de Javel. Il rend compte de la quantité totale de dichlore utilisé lors de la fabrication de l’eau de Javel. Toutefois, le % de chlore actif, pour une même qualité d’eau de Javel, dépend de la masse volumique de l’eau de Javel qui elle même varie avec le mode de préparation de l’eau de Javel. En effet, l’eau de Javel préparée par dilution d’eau de Javel à 24 – 26 % de chlore actif est moins dense (une partie des ions Na+ et Cl– a été retirée) qu’une eau de Javel préparée directement.
L’expression chlore actif désigne le chlore de l’hypochlorite, de nombre d’oxydation +I, qui est effectivement actif, mais aussi le chlore, de nombre d’oxydation -I, inactif comme oxydant, présent sous forme d’ions Cl–. L’expression chlore actif est donc, malgré son utilisation généralisée en Europe, impropre.
La correspondance entre °Chl et % de chlore actif peut être obtenue à l’aide de la relation suivante :
% chlore actif = 0,3165(°Chl / d) avec d = densité de l’eau de Javel
| % de chlore actif | °Chl | chlore actif g/L | Densité moyenne | pH | |
| Concentrés de Javel | 9,6 | 34,88 à 33,68 | 110,56 à 106,78 | 1,152 à 1,112 | 12,5 |
| Eau de Javel | 2,6 | 8,51 à 8,43 | 26,96 à 26,73 | 1,037 à 1,028 | 11,5 |
Normalisation :
- Les concentrés de Javel ont une concentration > 8,5 % de chlore actif.
- L’eau de Javel a une concentration comprise entre 2,5 et 8,5 % de chlore actif.
Propriétés
Composition : elle est fonction du pH, selon les équilibres chimiques suivants :
HClO + H+ + Cl– = Cl2 + H2O
HClO = H+ + ClO–
Composition d’une eau de Javel en fonction du pH
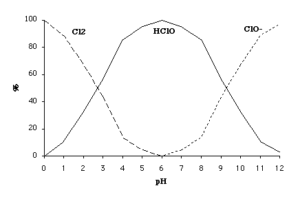
Stabilité :
- A pH < 5 les équilibres ci-dessus sont déplacés avec libération de Cl2, d’où la nécessité de ne pas employer l’eau de Javel en présence de produits acides et en particulier en présence de détartrants. La réaction de l’eau de Javel avec un acide (HCl par exemple) est une méthode de préparation de Cl2 au laboratoire.
- L’ion hypochlorite se dismute avec une élévation de température en donnant des ions chlorates selon la réaction :
3 ClO– = 2 Cl– + ClO3–
- La dissolution du dioxyde de carbone de l’air (HClO a un pKA = 7,5, celui de CO2 en solution aqueuse est de 6,4), en diminuant le pH de l’eau de Javel, peut entraîner un déplacement des équilibres chimiques dans le sens de la formation d’acide hypochloreux, très peu stable. Pour cette raison, un excès d’ions OH– (de 5 à 12 g/L exprimé en NaOH) est laissé pour neutraliser le CO2 de l’air. En conséquence, le pH d’une eau de Javel est basique (11,5 < pH < 12,5). C’est cette présence de soude qui rend irritant un concentré de Javel.
- L’ion hypochlorite, en solution dans l’eau, est fortement oxydant et il est, en particulier, susceptible d’oxyder l’eau. La réaction globale est la suivante :
ClO– = ½ O2 + Cl–
Cette réaction est lente, c’est elle qui impose une limite de durée d’utilisation : un an pour l’eau de javel, trois mois pour les concentrés.
La stabilité d’une eau de Javel est régie par les lois de la cinétique chimique. Par exemple, la vitesse de décomposition double lorsque la température s’élève de 5°C, les extraits se décomposent plus rapidement que l’eau de Javel diluée.
Cette décomposition peut être accélérée par divers catalyseurs tels que :
- les ions métalliques : pour cette raison, lors de sa fabrication et son stockage, elle ne devra pas être en contact avec des métaux, cuivre, zinc, fer, aciers courants, aciers inoxydables…
- la lumière et en particulier les rayonnements UV d’où la conservation de l’eau de Javel dans des récipients opaques non métalliques. L’ajout de dichromate de sodium destiné à colorer et à stabiliser l’eau de Javel vis-à-vis des UV n’est plus effectué, en France, depuis 1976.
Conservation :
En conséquence, une eau de Javel sera conservée dans des récipients non métalliques, opaques. Elle sera stockée à l’abri de la chaleur et diluée par de l’eau froide non polluée par des ions métalliques. Sa durée d’utilisation est limitée : environ 3 mois pour les concentrés, un an pour l’eau de Javel (voir l’article du BUP dans la bibliographie).
Propriétés oxydantes : l’eau de Javel est d’autant plus oxydante que son pH est faible, mais même à pH 14 son pouvoir oxydant reste élevé (E° = 0,88 V). Elle peut ainsi oxyder de nombreux composés toxiques en composés inoffensifs tels que par exemple : SO2, H2S, NH3, CN–… Son action décolorante et désinfectante est, en partie, due à sa capacité d’oxyder de nombreux composés organiques.
Propriétés désinfectantes : elles sont principalement dues au pouvoir bactéricide de l’acide hypochloreux qui diffuse à travers la paroi des cellules des bactéries en détruisant des protéines membranaires. Par ailleurs, HClO agit sur le métabolisme de synthèse des bactéries. HClO, non chargé, est près de 100 fois plus bactéricide que l’ion hypochlorite. Dans le cas des virus, HClO agirait par attaque des liaisons amidées des protéines.
Productions
En 2024, exprimée en chlore, la production de l’Union européenne en hypochlorites, y compris l’hypochlorite de calcium, a été de 1,991 million de t dont 810 253 t en Italie, 259 836 t en France, 247 591 t en Espagne, 194 713 t au Portugal, 72 742 t en Hongrie. Les productions belges, néerlandaises et allemandes sont confidentielles.
En Amérique du Nord, le principal producteur est Olin avec des capacités de production de 1 136 millions de litres avec des usines à Bécancour, dans la province du Québec au Canada et aux États-Unis à Augusta en Géorgie, Charleston dans le Tennessee, Lemont dans l’Illinois, Freeport au Texas, Henderson dans le Nevada, Mc Intosh dans l’Alabama, Niagara Falls dans l’État de New York et en Californie à Santa Fe Springs et Tracy.
Commerce international : pour les hypochlorites (hors celui de calcium), les chlorites et hypobromites, en 2024.
Principaux pays exportateurs sur un total de 1,078 million de t.
| Chine | 162 | Allemagne | 50 | |
| Canada | 115 | Portugal | 50 | |
| Belgique | 105 | États-Unis | 49 | |
| Espagne | 100 | France | 40 | |
| Pays Bas | 75 | Guatemala | 32 |
Source : ITC
Les exportations de la Chine sont destinées à 52 % à Hong Kong, 16 % à l’Inde, 6 % à Macao, 4 % au Brésil.
Principaux pays importateurs.
| États-Unis | 129 | Italie | 39 | |
| France | 116 | Pologne | 34 | |
| Canada | 51 | Hong Kong | 31 | |
| Allemagne | 45 | Inde | 27 | |
| Belgique | 44 | Singapour | 22 |
Source : ITC
Les importations des États-Unis proviennent à 89 % du Canada, 5 % d’Espagne, 3 % du Japon.
Situation française
Production, en 2006, de 245 millions de litres à 9,6 % de chlore actif. Chaque jour ouvré, utilisation d’environ 1 million de berlingots d’eau de Javel concentrée.
- Producteurs d’hypochlorite de sodium : Arkema à Jarrie (38) avec une capacité de production de 31 000 t/an, Inovyn, filiale d’Ineos, à Tavaux (39), Produits Chimiques de Loos, filiale du groupe Tessenderlo, à Loos (59), Vynova PPC, filiale de International Chemical Investors Group, à Thann (68), avec 44 000 t/an, Kem One à Lavéra (13) et Saint Fons (69), avec une capacité de production de 25 000 t/an.
- Conditionneurs d’eau de Javel : n°1, Cotelle, filiale de Colgate-Palmolive dans son usine de Rillieux-la-Pape (69), avec 80 000 t/an et la marque La Croix.
Commerce extérieur : en 2024.
Hypochlorites, hors celui de calcium, chlorites et hypobromites :
- Exportations : 39 985 t vers la Belgique à 62 %, l’Allemagne à 13 %, les Pays Bas à 8 %, la Suisse à 4 %.
- Importations : 116 330 t à 49 % d’Espagne, 25 % de Belgique, 14 % des Pays Bas, 5 % d’Allemagne, 4 % d’Italie.
Hypochlorite de calcium :
- Exportations : 930 t vers la Suisse à 35 %, l’Allemagne à 10 %, l’Espagne à 10 %, la Belgique à 6 %.
- Importations : 6 084 t à 66 % de Chine, 11 % d’Italie, 5 % d’Allemagne, 4 % du Royaume Uni, 4 % des États-Unis.
Utilisation
A 50 % à usage domestique pour son action en désinfection (HClO est bactéricide, fongicide, virucide et sporicide) et son pouvoir blanchissant.
Consommations : en 2005. Monde : 2,8 milliards de litres.
| États-Unis | 700 | Brésil | 350 | |
| Mexique | 600 | France | 245 | |
| Espagne | 400 | Italie | 220 |
Source : CSNEJ
En 2014-15, la consommation française est de 183 millions de litres.
Les consommations dans les pays nordiques sont faibles, inférieures à 4 millions de L/an et un peu plus importantes en Allemagne (35 millions de L/an), Royaume Uni, Belgique (44 millions de t/an) et Pays Bas.
Secteurs d’utilisation :
En 2015, aux États-Unis : à 67 % comme agent de blanchiment et à 33 % comme désinfectant.
- En pharmacie : les liqueurs de Labarraque et de Dakin sont à base d’eau de Javel. Dans les hôpitaux français l’eau de Dakin est utilisée pour l’antisepsie de la peau avant certains soins.
- En décontamination de matériel et de locaux : dans les hôpitaux français, l’eau de Javel est employée dans l’entretien des locaux. C’est un désinfectant particulièrement recommandé pour des risques infectieux importants (hépatites, virus HIV et Ebola, prions, SRAS et grippe aviaire).
- Dans le traitement de l’eau potable : l’eau de Javel ou le dichlore en solution donneront, au pH de l’eau, un mélange de HClO et de ClO–. Lors du traitement il est préférable d’ajouter l’eau de Javel après élimination des matières organiques afin d’éviter la formation de composés organochlorés. Les désinfectants les plus utilisés sont dans l’ordre : l’eau de Javel, l’ozone puis le dioxyde de chlore, l’eau de javel (ou l’hypochlorite de calcium) étant de loin les plus employés. L’ozone (O3) très efficace lors du traitement de l’eau présente l’inconvénient de ne pas rester dans l’eau distribuée et donc ne peut pas protéger d’une contamination ultérieure. Le dioxyde de chlore (ClO2) est produit in situ à partir de chlorite de sodium. Le tableau suivant rassemble les caractéristiques de ces divers désinfectants :
| Eau de Javel | Ozone | Dioxyde de chlore | |
| Coefficient spécifique de létalité lambda* pour :
– les bactéries |
20 |
500 |
20 |
| Durée du traitement | 45 min | 4 min | 30 min |
| Action sur NH3 | très bonne | nulle | nulle |
| Élimination de Fe2+, Fe3+, Mn2+ | faible | très bonne | bonne |
| Absence de goût, favorable pour la couleur | peu efficace | très efficace | efficace |
| Absence d’organochlorés | non | oui | oui |
| Coût de revient relatif | 1 | 20 | 10 |
* : Le coefficient lambda se détermine par l’étude de la mortalité, en fonction du temps, de microorganismes en suspension.
On a : Nt/No = e-λCt avec No et Nt : nombres de microorganismes aux temps 0 et t, λ: coefficient spécifique de létalité en L.mg-1.min-1, C : concentration du désinfectant.
En France, la chloration est de 0,2 à 0,3 mg/L. À New York, elle varie entre 0,7 et 2 mg/L, le goût d’eau de Javel y étant considéré comme le gage d’une eau saine. La concentration maximale admissible fixée par l’OMS est de 5 mg/L. À des concentrations inférieures aux doses létales, l’eau de Javel inhibe le développement des bactéries ce qui permet la protection de l’eau potable lors de son transport par canalisations.
Industriellement, l’eau de Javel est utilisée, en particulier, pour éviter le développement des algues et des mollusques dans les canalisations des usines de dessalement de l’eau de mer et dans les circuits de refroidissement des centrales thermiques classiques ou nucléaires utilisant l’eau de mer. Par exemple, la centrale de Gravelines utilise, lorsque la température de l’eau de mer dépasse 10°C, 0,8 mg de solution d’eau de Javel par litre d’eau de mer, avec un débit d’eau de 41 m3/s par réacteur de 900 MW.
Autres composés contenant des ions hypochlorite :
L’eau de Javel est une solution aqueuse. Il existe des composés renfermant des ions hypochlorites se présentant sous forme solide. Il s’agit principalement :
- de l’hypochlorite de calcium : utilisé seul ou sous forme de chlorure de chaux (mélange d’hypochlorite de calcium Ca(ClO)2 et d’hydroxyde de calcium Ca(OH)2), il représente environ 9 % de la consommation d’ions hypochlorites, l’hypochlorite de sodium en représentant 91 %. Utilisé principalement aux États-Unis pour la désinfection des eaux de piscines. Les principaux producteurs sont Westlake dans son usine de Natrium à New Martinsville en Virginie Occidentale et Lonza. 44 % de la consommation mondiale est destinée à la désinfection des eaux de piscines.
Aux États-Unis, l’hypochlorite de lithium est également employé, sa part est toutefois inférieure à 1 % du total des hypochlorites consommés. - du phosphate trisodique chloré, sel double de phosphate de sodium et d’hypochlorite de sodium NaClO,(Na3PO4,11H2O)4, utilisé aux États-Unis comme agent de nettoiement.
- des acides di- et trichloroisocyanuriques et leurs sels de sodium (appelés « trichlor » aux États-Unis) utilisés pour traiter les eaux de piscines. Ils libèrent lentement des ions hypochlorites au contact de l’eau et donnent de l’acide cyanurique qui absorbe les rayonnement UV et donc permet une plus grande stabilité de l’ion hypochlorite.
Bibliographie
- Site de l’ex Chambre Syndicale Nationale de l’Eau de Javel (CSNEJ).
- Fédération Hygiène et Entretien Responsable (FHER), 2 rue de Sèze, 75009 Paris.
- Dossier l’eau de Javel, CSNEJ, mai 2010.
- L’Actualité Chimique, janvier-février 1992, novembre 1994.
- Guy Durliat, Jean-Louis Vignes, Jean-Noël Joffin, « L’eau de Javel : sa chimie et son action biochimique« , BUP, n°792, 91 (1997) 451.
- Jean-Noël Joffin, « Hypochlorites et eaux de Javel« , document en ligne de 2015.